|
||||||||
S-1+docetaxel療法の忍容性試験(OGSG 0604)
Phase II feasibility study of adjuvant S-1 plus docetaxel for stage III gastric cancer patients after curative D2 gastrectomy (OGSG 0604).
Yutaka Kimura, et al.
本邦におけるstage II、III胃癌患者のD2郭清胃切除術後の補助化学療法は、S-1単独投与がACTS-GC試験1) によって確立されているが、stage IIIの成績は十分とはいえない。 一方、進行胃癌におけるS-1+docetaxel(doce)療法の治療成績は、奏効率56.3%、overall survival(OS)14.3ヵ月と報告されており2)、現在この結果をもとに、S-1 vs. S-1+doce療法の比較試験(JACCRO GC-03)が進行中である。 |
対象はstage IIIの胃癌で、6週間以内に根治目的のD2郭清胃切除術が施行された患者とした。治療スケジュールは下記の通りである。
S-1(80mg/m2/day/b.i.d, day1-14, 経口投与)+doce(40mg/m2, day1, iv投与)、1週休薬を1サイクルとし、4サイクル実施
S-1(80mg/m2/day)をday1-28に経口投与、2週休薬を1サイクルとし、術後1年まで実施
一次エンドポイントは、S-1+doce療法4サイクルの忍容性(治療完遂率75%以上)とした。二次エンドポイントは、安全性、disease-free survival(DFS)、OS、術後1年までのS-1投与の忍容性、とした。 |
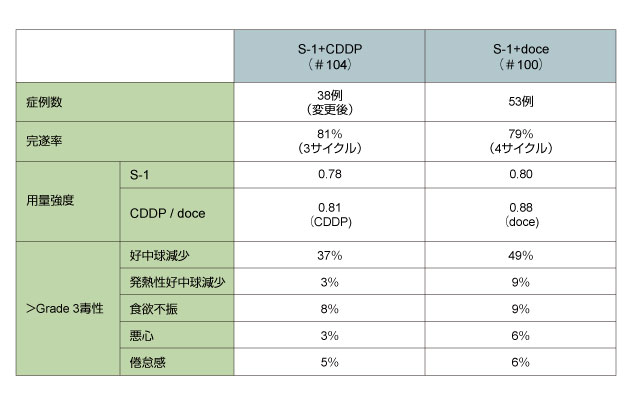
2007年5月〜2008年8月までに53例(男性42例/女性11例、年齢中央値65歳)が登録された。組織学的stage IIIAは36例、stage IIIBは17例であった。 追跡期間中央値20.1ヵ月時点において、DFSおよびOSは中央値に未到達であった。 |
術後補助化学療法としてのS-1+doce療法は忍容性に優れ、4サイクルの投与は完遂可能であると考えられた。追跡期間が短くOSの評価はできなかったものの、S-1+doce療法は、D2郭清胃切除術後のstage III胃癌に対する最適な補助化学療法と考えられる。 |
Feasibility study of adjuvant therapy with S-1 plus CDDP in gastric cancer.
Daisuke Takahari, et al.
Stage II、IIIの胃癌においては、根治目的のD2郭清胃切除術を施行した症例に対する術後補助化学療法として、S-1の有効性が示されている1)。しかしながら、stage IIIAならびにIIIBでは、満足のいく成績は得られていない。 |
対象は、日本人で、根治目的のD2郭清胃切除術を施行されたstage III胃癌患者(ECOG PS 0/1)とした。治療スケジュールは下記に示す通りである。途中、患者の術後の状態が安定せず、想定よりも多くの症例で好中球減少と食欲不振が認められたため、プロトコールを一部変更した。
S-1(40mg/m2/b.i.d, day 1-21, 経口投与)+CDDP(60mg/m2, day 8, iv投与)、2週休薬を1サイクルとし、3サイクル実施。その後、術後1年までS-1投与
S-1(40mg/m2/b.i.d)をday 1-28に経口投与、2週休薬。続けてS-1+CDDP療法(上記)を3サイクル行った後、術後1年までS-1投与
一次エンドポイントはS1+CDDP療法3サイクルの治療完遂率、二次エンドポイントは S-1+CDDP療法2サイクルの治療完遂率、プロトコール通りの治療を実施できた患者の割合、ならびに有害事象とした。なお、各サイクルにおいてS-1を14日以上かつCDDPを投与できた場合に治療完遂とみなした。 |
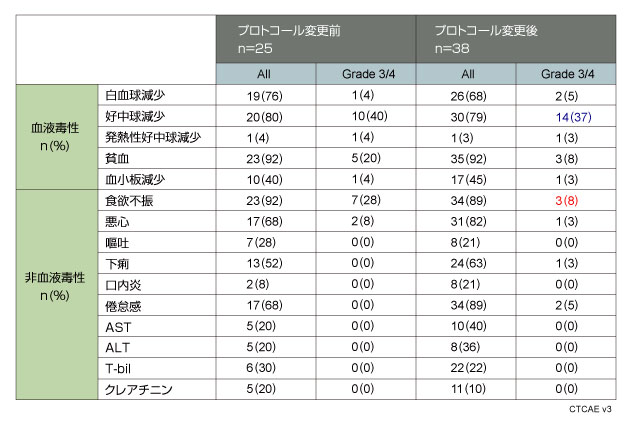
2007年8月から2009年7月までに、全63例に対しS-1+CDDP療法が施行された。プロトコール変更前の患者数は25例(男性16例/女性9例、年齢中央値60歳)、プロトコール変更後は38例(男性25例/女性13例、年齢中央値62歳)であった。
また、一次エンドポイントであるS-1+CDDP療法3サイクルの完遂率は、不適格症例を除き、プロトコール変更前症例で57%(12/21例)、変更後症例では81%(30/37例)と、プロトコール変更後症例で有意に増加した(p<0.001 under the null hypothesis)。 |
Stage III胃癌に対する術後補助化学療法としてのS-1+CDDP療法3サイクルは、1サイクルをS-1単独投与、2〜4サイクルをCDDP併用に変更することにより、安全性、忍容性が向上した。今後、第III相試験において、術後補助化学療法としてのS-1+CDDP療法の有効性を評価すべきと考えられた。 |
Reference |
【関連情報】
2007年 米国臨床腫瘍学会年次集会 速報演題レポート #4514
「進行胃癌に対するTS-1単独療法対TS-1/CDDP療法の無作為化第III相試験: SPIRITS試験」
「進行・再発胃癌に対するdocetaxel+TS-1併用療法の第II相試験」
Yoshida K, et al., Clin Cancer Res 2006; 12(11): 3402-3407
「進行胃癌に対するfirst-line治療としてのTS-1+CDDP療法とTS-1単独療法の第III相試験(SPIRITS試験)」
Koizumi W, et al., Lancet Oncol. 2008; 9(3): 215-221