5つの臨床試験の結果より(823例)
Safety of Panitumumab in Combination With Chemotherapy From 5 Clinical Trials in 823 Patients With Metastatic Colorectal Cancer and Wild-Type KRAS Tumors.
Jean-Yves Douillard, et al.
|
||||
Panitumumab(Pmab)は、完全ヒト型抗EGFRモノクローナル抗体であり、欧米ではKRAS 野生型の転移再発大腸癌に対する単剤療法として承認されている。 |
||||
対象としたのは、下表の5試験である。主な適格基準は、1)切除不能進行再発大腸癌と診断されている、2)18歳以上、3)抗EGFR抗体の治療歴がない、4)ECOG PS 0-2、などである。 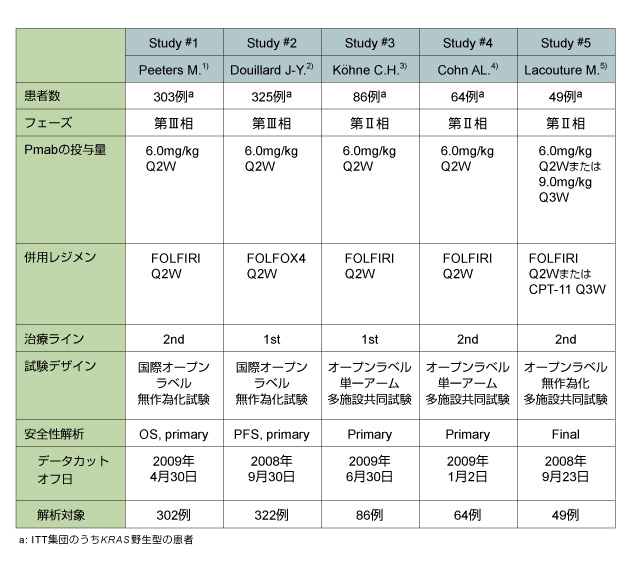 |
||||
治療に関連した有害事象の発現率は、全てのグレードを含めると96%(793/823例)であった。また、Grade3/4の主な有害事象は、皮膚毒性(35%)、好中球減少(28%)、下痢(17%)であった。 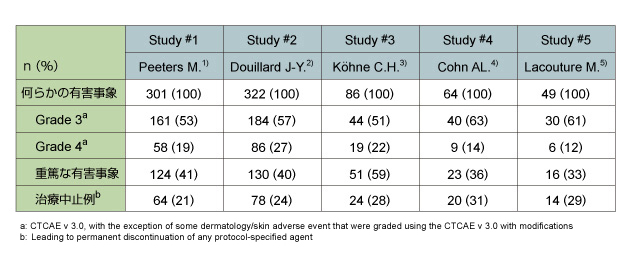 |
||||
以上より、KRAS 野生型の切除不能転移再発大腸癌患者において、PmabはFOLFOXおよびFOLFIRIとの併用療法においても、十分に忍容できることが示された。有害事象の発現状況は想定通りであり、最も頻度の高い有害事象は皮膚毒性で、全試験に共通していた。また、主なGrade3/4の有害事象は、下痢(17%)および低マグネシウム血症(5%)であり、panitumumabに関連したinfusion reactionの発現頻度は1%未満とまれであった。 |
||||
Reference |
||||
【関連情報】
2009年 米国臨床腫瘍学会年次集会 速報演題レポート #4067
「大腸癌に対するpanitumumabレジメンにおける治療の初期反応を評価する試験(PRECEPT試験)の結果報告: panitumumab+FOLFIRIによる二次治療と
KRAS status」
2009年 米国臨床腫瘍学会年次集会 速報演題レポート#4085
「転移を有する大腸癌に対する一次治療としてのpanitumumab+FOLFIRI併用療法の第II相試験(20060314)の最新解析」
2009年 米国臨床腫瘍学会年次集会 速報演題レポート#4027
「転移性大腸癌におけるpanitumumab治療時の皮膚障害に対する予防的治療と対症的治療の比較試験:
STEPP試験の最終解析」


