A Randomized, Phase 1/2 Trial of AMG 102 or AMG 479 in Combination With Panitumumab vs Panitumumab Alone in Patients With Wild-Type KRAS Metastatic Colorectal Cancer (mCRC) : Safety and Efficacy Result.
Eric Van Cutsem, et al.
|
|||||||||
新規分子標的治療薬であるRilotumumab (AMG102) およびGanitumab (AMG479) は、各々c-Met受容体に対するリガンドであるHGF (hepatocyte growth factor: 肝細胞増殖因子) およびIGF-1R (insulin-like growth factor 1 receptor: インスリン様増殖因子1受容体) に対する完全ヒト型モノクローナル抗体である。 |
|||||||||
本試験は3つのパートから成る。各パートの概要は以下の通りである。
Part 1の一次エンドポイントは用量制限毒性 (dose-limiting toxicities: DLTs)、Part 2は奏効率 (objective response rate: ORR) とした。また、Part 2においては無増悪生存期間 (progression-free survival: PFS) および全生存期間 (overall survival: OS)、安全性、薬物動態、バイオマーカーについても解析を実施した。今回は、Part1、Part2の結果を報告する。 |
|||||||||
|
Part 1の結果より、Panitumumab 6mg/kg + Rilotumumab 10mg/kg、2週毎投与をPart 2に採用した。Part 2では2009年6月から2010年2月までに、11ヵ国37地域から142例の患者が登録された。追跡期間中央値は6.9ヵ月であり、現在も追跡中である。 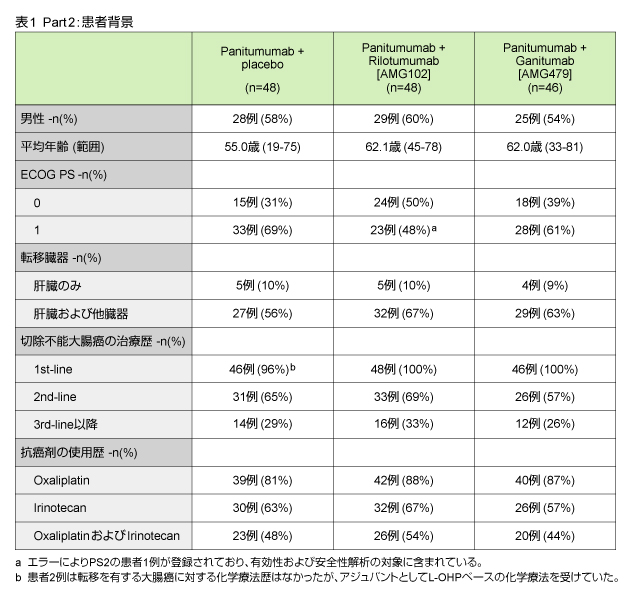
一次エンドポイントであるORRは、Panitumumab単独群21%、Rilotumumab併用群31%、Ganitumab併用群では22%であり、疾患制御率 (disease control rate: DCR) は各々56%、71%、61%であった。奏効期間中央値は3.7ヵ月、5.1ヵ月、3.7ヵ月であり、Rilotumumab併用群でわずかに良好であった (表2)。 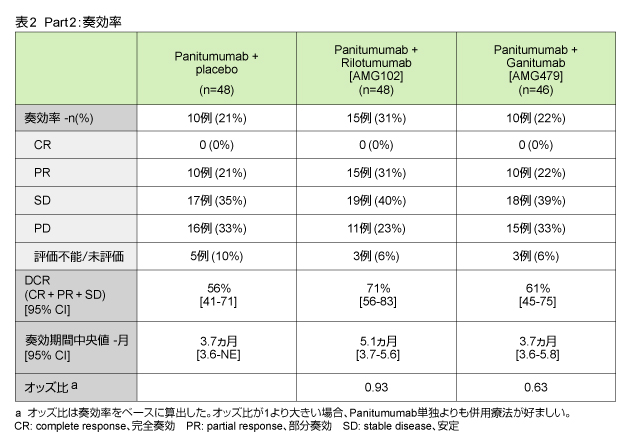
また、PFS中央値は各々3.7ヵ月 (95% CI: 2.5-5.3)、5.2ヵ月 (3.6-5.4)、5.3ヵ月 (2.7-5.7)であり、Panitumumab単独群に対する各群のハザード比はRilotumumab併用群で0.96 (95% CI: 0.61-1.51)、Ganitumab併用群では0.89 (95% CI: 0.56-1.42) であった。 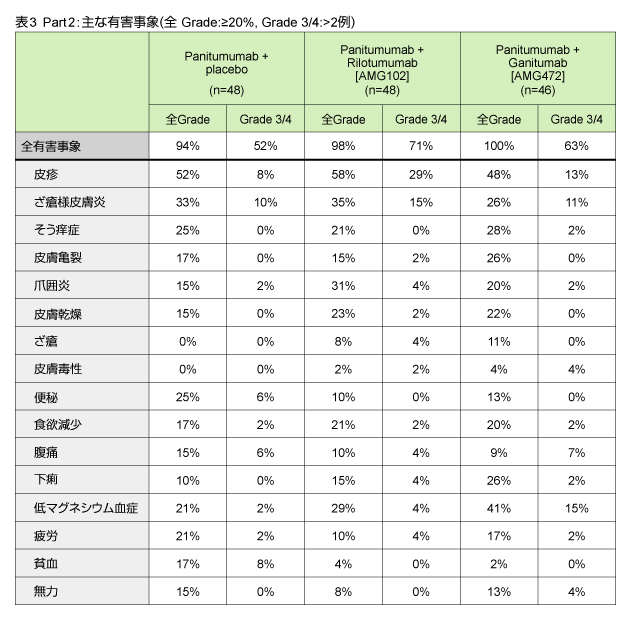
|
|||||||||
本試験は切除不能大腸癌患者においてHGF (c-Met pathway) 阻害剤であるRilotumumab + Panitumumab併用療法の有効性を検討した初めての試験であり、Rilotumumabの上乗せ効果が期待できる結果が得られた。一方、Ganitumab + Panitumumabの併用では、ORRにおけるGanitumabの上乗せ効果は認められなかった。 |
|||||||||
Reference
1) Saltz LB, et al.: J Clin Oncol. 25(29): 4557-4561, 2007 [PubMed][論文紹介]
2) Tol J, et al.: N Engl J Med. 360(6): 563-572, 2009 [PubMed][論文紹介]
3) Hecht JR, et al.: J Clin Oncol. 27(5): 672-680, 2009 [PubMed]
【関連リンク】
論文紹介
CPT-11抵抗性結腸・直腸癌におけるcetuximab + bevacizumab + CPT-11併用療法とcetuximab + bevacizumab併用療法の無作為化第II相試験: BOND-2試験 (Saltz LB, et al.: J Clin Oncol. 2007)
2008年 米国臨床腫瘍学会年次集会 速報レポート
#LBA4011 「進行結腸・直腸癌に対するcapecitabine + oxaliplatin+bevacizumab ± cetuximab療法の無作為化第III相試験 (CAIRO2試験)」
論文紹介
転移性結腸・直腸癌に対する化学療法 + bevacizumab + cetuximabと化学療法 + bevacizumabの比較 (Tol J, et al.: N Engl J Med. 2009)
2009年 消化器癌シンポジウム 座談会
進行・再発大腸癌に関する注目演題「抗VEGF抗体/抗EGFR抗体の併用は是か非か」
2010年 米国臨床腫瘍学会年次集会 速報レポート/#4035
遠隔転移を有する膵癌を対象としたconatumumab + gemcitabine療法、AMG479 + gemcitabine療法、placebo + gemcitabine療法の無作為化第II相比較試験

