SPIRITT試験の安全性報告
Pooled Safety Results from SPIRITT: A Multicenter, Open-label, Randomized, Phase 2 Study of FOLFIRI with Panitumumab or Bevacizumab as 2nd-line Treatment in Patients with Metastatic Colorectal Cancer (mCRC)
J. Randolph Hecht, et al.
|
||||||
現在、治癒切除不能な大腸癌患者においてBevacizumabを含むレジメンにて進行が認められた場合、前向きかつ無作為化にて検討したデータはないものの、その多くは二次治療においても継続してBevacizumabを併用した治療が実施されている。 |
||||||
L-OHPベースの化学療法にBevacizumabを併用した一次治療に不耐あるいは進行が認められた患者を対象とし、FOLFIRI + Bevacizumab群とFOLFIRI + Panitumumab群に無作為に割り付けた。Bevacizumabの投与量は各施設の標準用量、Panitumumabは6mg/kgとし、両群とも2週毎の投与とした。
|
||||||
|
2010年3月9日のデータカットオフ時点で、登録予定277例のうち216例が登録された。基準を満たした214例 (99%) のうち175例 (81%) は投与終了、39例 (18%) が投与継続中であった。 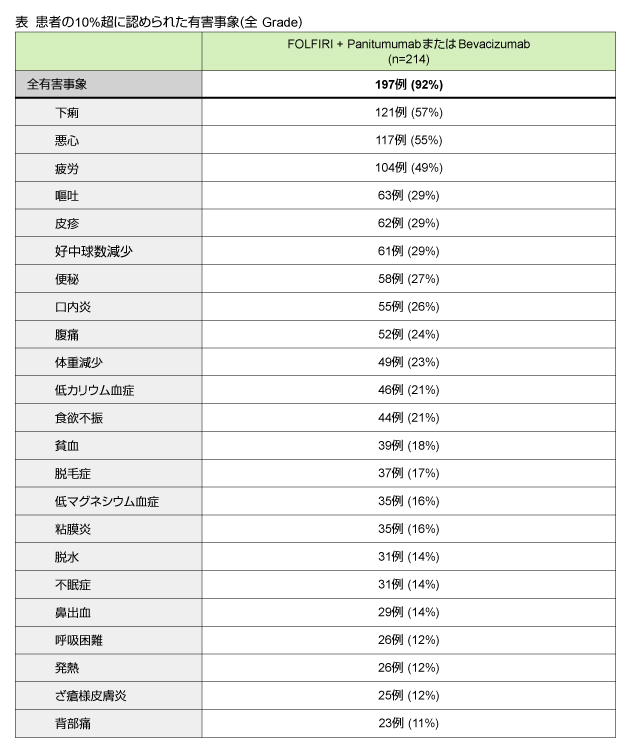
|
||||||
安全性プロファイルは、切除不能な大腸癌患者に対する二次治療として、FOLFIRIと抗VEGF抗体あるいは抗EGFR抗体を併用した場合に予測される範囲内のものであった。本試験は2010年12月に患者登録が終了しており、現在追跡中である。 |
||||||
Reference
1) Peeters M, et al.: J Clin Oncol. 28 (31): 4706-4713, 2010 [PubMed]
【関連リンク】
Panitumumab座談会
What is Panitumumab? ―進行再発大腸癌におけるPanitumumabの位置づけ
GI-pedia 第1回「大腸癌化学療法の変遷 (進行再発癌)」
3. Targeted therapy/3.3.3 FOLFIRI + Panitumumab
化学療法のレジメ講座
FOLFIRI + Panitumumab
2010年 米国臨床腫瘍学会年次集会 速報レポート
#3565/ 3566 「切除不能進行・再発大腸癌二次治療例に対するFOLFIRI ± panitumumab療法の無作為化比較第III相試験 (20050181試験) /初回治療例に対するFOLFOX4 ± panitumumab療法の無作為化比較第III相試験 (PRIME試験) : EGFR染色結果の検討」
2010年 消化器癌シンポジウム レポート
#282 「切除不能進行再発大腸癌における2nd-line治療としてのFOLFIRI ± panitumumab療法の第III相試験: 患者によるQOL評価 (PRO) を含む中間解析結果」

