
Abstract #6
局所進行または転移を有する胃および胃食道接合部 (GEJ) 腺癌に対する二次治療としてのPEP02、Irinotecan、Docetaxel単独療法の無作為化比較第II相試験
A Randomized Phase II Study of PEP02, Irinotecan, or Docetaxel as a Second Line Therapy in Patients with Locally Advanced or Metastatic Gastric or Gastroesophageal Junction Adenocarcinoma (PEP0206).
David Cunningham, et al.
|
PEP02 −新しいIrinotecanのリポソーム製剤は有用か? |

|
PEP02は、Irinotecan (CPT-11) をナノ粒子であるリポソームに封入した新しい薬剤であり、腫瘍細胞内に長時間蓄積してより高い抗腫瘍効果を発揮し、かつ正常細胞への影響を軽減することが期待されている。本試験では、胃および胃食道接合部腺癌における二次治療としてPEP02、CPT-11、Docetaxelの有効性と安全性が評価された。
これらの抗癌剤のなかで、PEP02群とDocetaxel群において一次エンドポイントである腫瘍縮小効果を達成したが、全生存期間 (overall survival: OS) については3群間で差はみられなかった。PEP02の安全性プロファイルはCPT-11に類似しており、PEP02の薬物動態プロファイルはCPT-11と比較し、CPT-11あるいは活性型SN38のCmaxは低値、T1/2は延長、AUC 0→∞ は高値を示し、薬物動態を改善した。
本試験における基本治療スケジュールは、PEP02群は120mg/m2であったが、PEP02群のうち、150mg/m2まで増量可能であった5例においては、腫瘍縮小効果が60%、疾患制御率 (disease control rate: DCR) が100%、無増悪生存期間 (progression-free survival: PFS) 中央値が181日、OS中央値が235日と大変良好であったことより、PEP02群の投与量は可能であれば150mg/m2が望ましいのかもしれない。
また、Gemcitabine抵抗性の転移を有する膵癌症例に対し、二次治療としてPEP02の単剤投与に関する第II相試験が行われ、有効性と安全性に関する結果が同様に2011年 消化器癌シンポジウムにて報告された1)。その結果は、一次エンドポイントである3ヵ月生存率 ( >65%) が74%と良好であった。
これらの2報より、胃癌および膵癌におけるPEP02の有効性を示唆する結果が得られた。ドラッグデリバリーシステムという観点から、PEP02はCPT-11の改良バージョンと考えられる。同じ薬剤でも有害事象を減らし、有効性を高めることは重要であり、PEP02は興味深い薬剤である。CPT-11はいろいろな癌種に使用されているため、CPT-11が有効な癌種にはPEP02が効果を示す可能性が高く、今後の発展が期待される。
|
|
| |
 |
PEP02は、CPT-11をナノ粒子であるリポソームに封入した新しい薬剤である。CPT-11をリポソームに封入することにより、腫瘍細胞内に長時間蓄積してより高い抗腫瘍効果を発揮し、かつ正常細胞への影響を軽減することが期待されている。第I相試験では、胃癌を含むいくつかの癌種においてPEP02の有用性が示されている。
本試験は、胃および胃食道接合部 (gastroesophageal Junction: GEJ) 腺癌に対する単剤療法として、PEP02、CPT-11、Docetaxelの各薬剤の有効性および安全性を評価するために実施された。 |
 |
本試験は欧州およびアジアにおいて、Simonの2段階デザインを用いて実施された。対象は、化学療法歴のある局所進行または転移を有する胃および胃食道接合部腺癌患者をとし、PEP02群、CPT-11群、Docetaxel群の3群に無作為に割り付け、比較・検討を行った。
治療スケジュールは、PEP02群は120mg/m2、CPT-11群は300mg/m2、Docetaxel群では75mg/m2を、それぞれ3週毎に投与することとした。なお、PEP02群においては、1サイクル目でGrade 1を超える治療関連毒性が発現しなかった場合、150mg/m2まで増量可能とした。
評価項目は下記の通りである。
|
|
腫瘍縮小効果 (objective tumor response), α=0.05, β=0.10, H0: p=0.05 |
|
|
|
|
|
DCR、OS、PFS、1年生存率、安全性
[以下、PEP02およびCPT-11群のみ] |
|
|
薬物動態 (pharmacokinetics: PK)、UGT1A1およびUGT1A9の薬剤感受性 |
|
 |
|
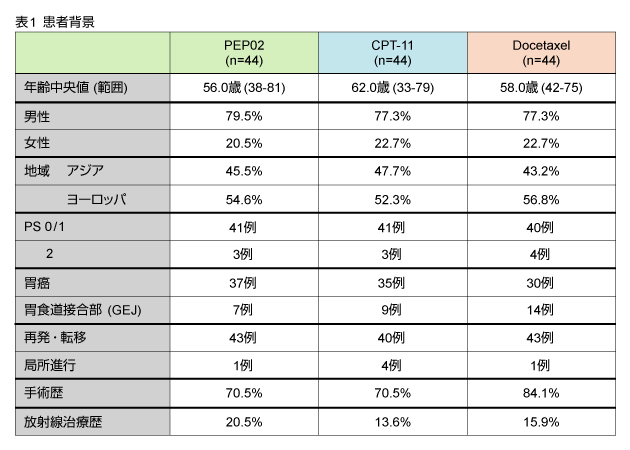
2008年1月から2010年6月までに6ヵ国22施設から135例が登録され、そのうち132例、各群44例ずつをintention-to-treat (ITT) 解析の対象とした。患者背景は表1に示す通りである。
一次エンドポイントである腫瘍縮小効果 (CR + PR) は、PEP02群で13.6%、CPT-11群で6.8%、Docetaxel群では15.9%に認められた (表2) 。PEP02群およびDocetaxel群において一次エンドポイントを達成したが、CPT-11群では達成しなかった。DCRは各々61.4%、61.4%、54.6%であったが、PFS中央値およびOS中央値は3群間でほぼ同等であった。
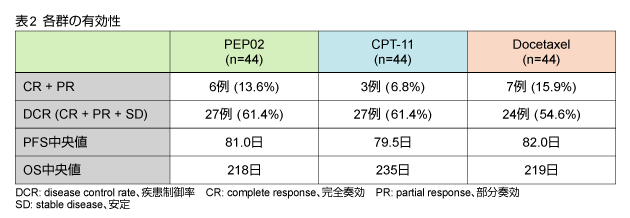
PEP02群のうち、150mg/m2まで増量できた5例においては、腫瘍縮小効果が60%、DCRが100%、PFS中央値が181日、OS中央値が235日と良好であった。
また、地域別の解析では、全体のPFS中央値はアジアで78.5日、欧州で81.0日とほぼ同等であったが、OS中央値についてはアジアで267日、欧州では181日であり、有意差が認められた (p=0.011)。これは、アジアにおいて、胃癌に対する3rd-line以降の化学療法が普及していることが一因と考えられた。
Grade 3/4の主な有害事象としては、好中球数減少がPEP02群で11.4%、CPT-11群で15.9%、Docetaxel群では15.9%に、下痢が各々27.3%、18.2%、2.3%に認められた。また、Grade 1/2の手足症候群が各々0%、6.8%、18.2%に認められた。
PEP02およびCPT-11投与90分後の患者におけるSN-38のPKパラメーター平均値は、半減期 (T1/2) がPEP02群で88.8hr、CPT-11群では22.8hr、最高血中濃度 (Cmax) が各々8.79ng/mL、44.1ng/mL、血中濃度曲線下面積 (AUC) 0→∞ が879 hr*ng/mL、440 hr*ng/mLであった。

|
 |
PEP02群およびDocetaxel群において、一次エンドポイントである腫瘍縮小効果を達成した一方、生存については3群間で差はみられなかった。
PEP02の安全性プロファイルはCPT-11に類似し、神経毒性および手足症候群はDocetaxel群によりも低頻度であったが、薬物動態プロファイルはCPT-11と比べ、Cmaxは低値、T1/2は延長、AUC 0→∞ は高値を示した。また、PEP02に忍容性を示す患者においては、投与量を150mg/m2に増量することを考慮すべきかもしれない。
|
Reference
1) Ko AH, et al.: 2011 Gastrointestinal Cancers Symposium: abst #237



