GERCOR 第II相試験 (ERaFOX) の最終報告
Chemoradiation with FOLFOX plus Cetuximab in Locally Advanced Cardia or Esophageal cancer. Final Results of a GERCOR phase II Trial (ERaFOX).
Aimery de Gramont, et al.
|
||||||||||||
局所進行胃噴門部癌および食道癌に対するCRTでは、5-FUにCDDPを加えたレジメンが用いられているが、CDDPをOxaliplatin (L-OHP) に置き換えることにより良好な効果が得られることが確認されてい |
||||||||||||
本試験は、オープンラベルシングルアーム多施設共同第II相試験である。対象は、stage IIIの食道または胃噴門部 (GEJ: 胃食道接合部) の腺癌ならびに扁平上皮癌とした。治療スケジュールを下記に示す。
腫瘍の評価は、ベースラインおよびCRT終了時に臨床所見、CT、内視鏡検査および腫瘍組織の生検、超音波内視鏡検査 (EUS) によって行った。一次エンドポイントはORR とした。 |
||||||||||||
|
2007年11月から2010年2月までに、12施設から80例が登録され、うち79例を対象に解析を行った。患者背景は、男性60例/女性19例、年齢中央値63歳、PS 0=47例/1=31例/不明1例であった。組織型は扁平上皮癌53例、腺癌25例、未分化型癌1例であり、腫瘍の部位は食道74例、胃噴門部5例であった。 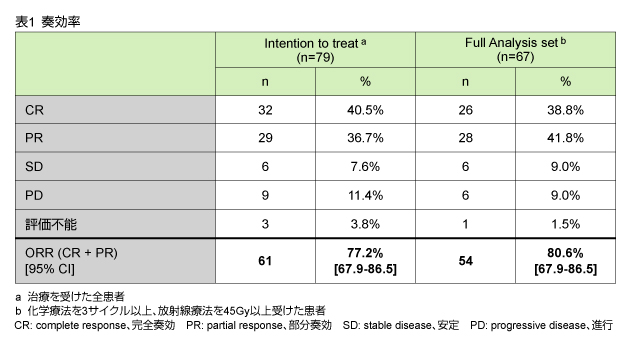
Grade 3/4の有害事象は表2に示す通りである。なお、RCT終了後、消化管出血を伴う食道炎による治療関連死が1例 (1.3%) に認められた。 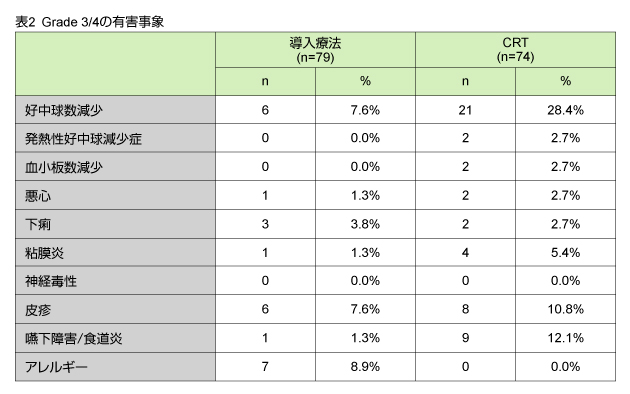
|
||||||||||||
本試験のORRは、治療閾値として設定した50%を上回る77.2%に到達し、また扁平上皮癌、腺癌の双方とも75%以上の症例で奏効が認められた。頻度の高いGrade 3/4の有害事象は、好中球減少および嚥下障害、皮疹などであり、忍容可能であった。以上より、本試験の治療戦略の有用性を第III相試験によって評価すべきである。 |
||||||||||||
Reference
1) Igaki H, et al.: 2008 Annual Meeting of the American Society of Clinical Oncology®: abst #4510 [学会レポート]
2) Tepper J, et al.: J Clin Oncol. 26(7): 1086-1092, 2008 [PubMed]
3) Stahl M, et al.: J Clin Oncol. 27(6): 851-856, 2009 [PubMed]
4) Conroy T, et al.: Br J Cancer. 103(9): 1349-1355, 2010[PubMed]
5) Ruhstaller T, et al.: J Clin Oncol. 2011 Jan 4. [Epub ahead of print][PubMed]
6) Lorenzen S, et al.: Ann Oncol. 20(10): 1667-1673, 2009 [PubMed]
7) Alberts SR, et al.: 2010 Annual Meeting of the American Society of Clinical Oncology®: abst #CRA3507 [学会レポート]
8) Maughan TS, et al.: 2010 Gastrointestinal Cancers Symposium: abst #402 [学会レポート]
【関連リンク】
2008年 米国臨床腫瘍学会年次集会 速報レポート
#4510 「臨床stage II/IIIの胸部食道扁平上皮癌に対する5-FU + cisplatinによる術後補助化学療法と術前補助化学療法の無作為化比較試験: JCOG9907試験」
論文紹介
食道癌に対する術前補助化学療法 + 手術と手術単独の無作為化試験の長期成績 (Allum WH, et al.: J Clin Oncol. 2009)
2010年 米国臨床腫瘍学会年次集会 速報レポート
#4004 「切除可能な食道および食道胃接合部癌患者の生存に与える術前化学放射線療法の効果: 多施設共同無作為化第III相試験」
2010年 米国臨床腫瘍学会年次集会 速報レポート
#4005 「局所限局食道癌に対する手術単独療法 (S群) と術前化学放射線療法 + 手術療法 (CRT群) の検討: 無作為化第III相試験FFCD 9901」
2010年 米国臨床腫瘍学会年次集会 速報レポート
#4022 「局所進行胃・胃食道接合部・下部食道腺癌に対する術前補助化学療法と手術単独療法のメタ解析」
2010年 米国臨床腫瘍学会年次集会> 速報レポート
#4053 「局所進行胸部食道扁平上皮癌に対する低用量cisplatin + 5-FU放射線同時併用療法と標準量cisplatin + 5-FU放射線同時併用療法: 多施設共同無作為化比較第II/III相試験 (JCOG 0303)」

