 |
 |
| はじめに−GISTの定義 / 診断
/ 分子標的治療 / 今後の問題 |
| はじめに−GISTの定義 |
| |
Gastrointestinal Stromal Tumor(GIST)の定義は、KITタンパク質を発現する特有の形態学的特徴を有する紡錘形ないし類上皮形腫瘍細胞からなる間葉系腫瘍である。その発生原因はc-kit遺伝子(KITタンパク質をコード)や血小板由来増殖因子受容体α(plateletderived
growth factor receptor:PDGF-Rα)遺伝子の機能獲得型変異である1〜3)。KITタンパク質を95%以上に発現、CD34は70〜80%に発現、形態学的にinterstitial
cells of Cajal(ICCs)に類似する1〜3)。
GISTは平滑筋層のある食道から直腸までのすべての消化管と、稀ではあるがKIT陽性紡錘形細胞の存在する腹膜、後腹膜、膀胱、胆嚢に発生する。発症頻度は、人口100万人あたり20人/年と推測され、全消化管腫瘍の0.5〜1%程度の腫瘍である。50代以降の中高年に比較的高頻度に発症し、臓器別頻度では、胃(70%)が最も多く、小腸(20%)・大腸(5%)・食道(数%)・消化管外(数%)の順である1〜3)。GISTと平滑筋(肉)腫、神経鞘腫を併せて消化管間葉系腫瘍(gastrointestinal
mesenchymal tumors:GIMT)と呼ぶ。この腫瘍群の鑑別は肉眼的には困難で、それぞれ表1に示すような特徴を持つ。この3腫瘍の中で最も発生頻度が高いのがGISTで、GISTはGIMTの70〜80%を占め、筋原性腫瘍は10〜20%、神経原性腫瘍は約10%を占める。 |
| 表1 消化管間葉系腫瘍の臨床所見 |
| |
 |
| |
筋原性
平滑筋(肉)腫 |
神経原性
神経鞘腫、
神経線維腫 |
GIST |
| 頻度 |
10〜20% |
〜10% |
70〜80% |
| 症状発現 |
少ない |
少ない |
やや多い |
| 好発部位 |
食道胃噴門大腸 |
胃 |
胃小腸 |
| 浸潤・転移・播種 |
稀 |
稀 |
時々 |
| 細胞型 |
spindle |
spindle |
spindle epithelioid |
| 免疫染色 |
desmin |
S-100 |
KIT CD34 |
| 細胞分裂像 |
ほとんど無し |
ほとんど無し |
低〜高 |
| 細胞密度 |
低 |
低 |
中〜高 |
| KIT&PDGF-R変異 |
― |
― |
+(90〜95%) |
| 再発・予後 |
良好 |
良好 |
やや不良 |
|
 |
|
| |
▲このページのトップへ |
| 診断 |
| |
1.GISTの診断(図1)
GISTに特異的な症状はなく、しばしば5cmを超える腫瘍になっても無症状のことがある。主な症状は、吐血・下血とそれに伴う貧血(消化管出血)、腹部鈍痛、腫瘤触知である。本邦では胃・十二指腸GISTの半数以上が無症状で発見される。一方、小腸・大腸GISTのほとんどは上記症状の精査中に発見される1)。有症状GISTは大きく、相対的に予後不良の場合が多い。
GISTの最終診断は組織診断で、原則として組織を生検ないし手術で得る必要がある。採取された組織は、HE染色で紡錘形ないし類上皮形腫瘍細胞を確認、KIT、CD34、desmin、S-100染色を行い、KITタンパク質を発現するものをGISTと診断する。感度にもよるが免疫組織染色ではKIT陰性GISTも5%に存在する。この場合c-kitあるいはPDGF-Rα遺伝子変異の存在確認は重要である。
GISTは筋原性や神経原性腫瘍に比較し、組織学的にも臨床的にも悪性度が高い傾向があり、細胞密度や多形性が高く、腫瘍細胞分裂も多く、腫瘍径が大きく、周囲臓器浸潤、腹膜播種、同時性転移を伴うことも稀ではない(表1)。GISTのリスク評価は最大腫瘍径と強拡大での腫瘍細胞分裂像数で行われ、臨床的予後と比例する(表2)。 |
| 図1 GIST臨床診断手順 |
| |
|
| |
|
| 表2 GISTのリスク分類 |
| |
 |
| |
腫瘍径 |
腫瘍細胞分裂像数 |
| Very low risk |
<2 |
cm |
<5/50 |
HPF |
| Low risk |
2-5 |
cm |
<5/50 |
HPF |
| Intermediate risk |
<5 |
cm |
6-10/50 |
HPF |
| |
5-10 |
cm |
<5/50 |
HPF |
| High risk |
≧5 |
cm |
5-10/50 |
HPF |
| |
≧10 |
cm |
無関係 |
| |
無関係 |
≧10/50 |
HPF |
| (HPF:400倍視野での一視野あたりの平均細胞分裂像数) |
|
 |
|
| |
▲このページのトップへ |
| |
2.GISTの発生と遺伝子変異
GISTの発生原因はc-kitないしPDGF-Rα遺伝子変異によりKITないしPDGF-Rαタンパク質下流の細胞内シグナル伝達系の活性化、すなわち、 1.抗アポトーシス作用の亢進(PI3Kを介する)と
2.細胞増殖の促進(Ras-MAPK系の活性化)が関連する(図2)。c-kit遺伝子変異はGISTの80〜90%に認め、変異部位は、アミノ酸単位のdeletionが主のエクソン11(70〜80%)、2アミノ酸挿入のエクソン9(10〜20%)、アミノ酸置換型のエクソン13と17(それぞれ2〜3%)がある。PDGF-Rα遺伝子はc-kit遺伝子と基本構造はほとんど同じで、その変異部位は、deletionを主としたエクソン12(〜2%)、アミノ酸置換が主のエクソン14(〜1%)とエクソン18(〜3%)である。
重要なことはc-kitやPDGF-Rα遺伝子変異が、主に腫瘍化とその後の腫瘍細胞増殖を制御していることである。すなわち、これら分子の特異的阻害剤:メシル酸イマチニブ(以下イマチニブ)のキナーゼ阻害効果とGISTに対する臨床効果は比例し、c-kit遺伝子エクソン11変異とPDGF-Rα遺伝子エクソン12変異≧c-kit遺伝子エクソン13変異〜PDGF-Rα遺伝子エクソン14変異>c-kit遺伝子エクソン9変異≫c-kit遺伝子エクソン17変異とPDGF-Rα遺伝子エクソン18変異の順に阻害効果も臨床効果も高い。逆に、c-kitやPDGF-Rα遺伝子変異のないGISTにはイマチニブの効果は少ない。 |
| 図2 GISTの増殖機構 |
| |
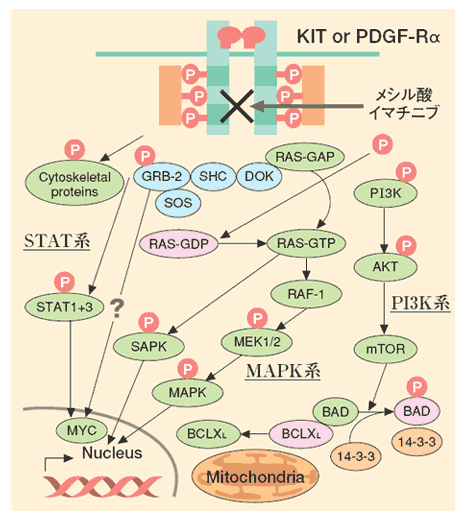 |
| GISTのKITとPDGF-Rαを中心とした主な細胞内シグナル伝達系 (文献2より一部変更) |
|
| |
▲このページのトップへ |
| 分子標的治療 |
| |
1.イマチニブの臨床薬理学
イマチニブは血中半減期が約16〜18時間で、1日1〜2回の経口投与薬剤である。食餌と一緒に内服しても90%以上の非常に高い吸収効率を示す4)。代謝は肝代謝で、主にシトクロームP450(CYP3A4)により代謝される。標的分子は、開発目標とされたBcr-Ablチロシンキナーゼの他、Abl、KIT、PDGF-Rである。イマチニブはKIT、PDGF-Rαに関しては、野生型のキナーゼよりも細胞膜周囲の変異により恒常的活性化した変異型チロシンキナーゼにより強く結合し、高い活性阻害効果と臨床効果を示す。 |
| |
2.臨床効果
イマチニブの臨床試験は切除不能GISTに行われ、中間解析結果では以下の通りである5〜7)。
| 1 |
投与量400mg/日と600mg/日の奏効率と有害事象に有意な差はなかった。 |
| 2 |
CR(complete response:完全消失)は稀で、効果発現までの期間は平均13週、奏効率はpartial
response(PR:腫瘍面積が50〜99%縮小)約60%、stable disease(SD:腫瘍面積0〜±49%の変化)約25%、病変コントロール率(PR+SD)は約85%を示す。6ヵ月以上のlong
SDとPRは予後において同等の効果を持つ。早期耐性(180日以内の進行、PD:progressive disease:腫瘍面積の50%以上の増大)を約15%に認めた。投与後1〜2年の生存率は改善した。 |
| 3 |
効果のあった症例では腫瘍は縮小ないし腫瘍細胞のアポトーシスと血流の低下によりCT上low density lesion(液状変性)となる。 |
| 4 |
有効例では[18F]fluoro-2-deoxy-D-glucose(FDG)を用いたpositron
emission tomography(PET)で、投与後数日の非常に早い時期より腫瘍細胞のFDGの取り込みが低下ないし消失する(図3)。 |
| 5 |
c-kitやPDGF-Rα遺伝子変異の部位によりイマチニブの奏効率が異なる。 |
|
| 図3 イマチニブのGISTへの効果 |
| |
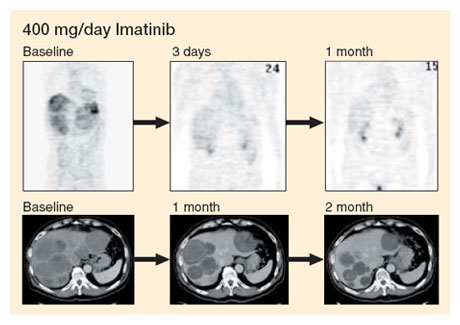 |
| 上段はFDG-PETによる評価で、より早期の評価が可能である。この症例はPETではCR。下段は通常のCT検査で、イマチニブ投与により、まず病変は低吸収病変となり、その後腫瘍径は縮小している。CTではPR |
 |
|
| |
3.有害事象(副作用)
ほとんどの症例に薬剤関連有害事象を認める5〜7)。頻度順に、1.水分貯留(眼球周囲浮腫、下肢浮腫、顔面浮腫、全身浮腫、胸水、腹水)
2.消化器症状(悪心、下痢、腹痛、鼓腸・放屁、嘔吐等) 3.筋肉痛・筋痙直 4.全身倦怠感
5.皮疹 6.頭痛 7.血液毒性(貧血、好中球減少)である。GISTに特徴的な有害事象として腫瘍出血と消化管出血がある。日本人で注意すべき点は、grade
3以上の血液毒性が20%近くに見られることである。 |
| |
4.耐性の問題
CML(chronic myeloid leukemia:慢性骨髄性白血病)の治療においてイマチニブは高い臨床効果を示したが、その後、使用の継続とともに多くの症例で耐性が生じた8)。GISTにおいても同様のことが起こりつつある。イマチニブ使用後180日以内の進行を初期耐性と定義、SDまたはPR確定後の進行を後期耐性とする。初期耐性はKITとPDGF-Rα遺伝子変異のないGIST、または遺伝子変異があってもそれぞれキナーゼ領域の変異を持つGISTに見られる。後期耐性はclonalに生じるとされており、その機構として
1.新規の耐性型c-kit(またはPDGF-Rα)変異(キナーゼ領域の変異)―すなわちtarget resistance
2.c-kit(またはPDGF-Rα)遺伝子増幅、KIT(またはPDGF-Rα)タンパク質発現増加 3.KIT非依存性増殖能の獲得等々が考えられる。 |
| |
▲このページのトップへ |
| 今後の問題 |
| |
GISTとイマチニブに関しいくつかの未解決の問題やコンセンサスの得られていない事項がある。これらに対して、guideline
を作成しようという試みがあり、アメリカとヨーロッパの臨床腫瘍医を中心に作成されつつある。近日中に発表される予定である。 |
| |
|
| 参考文献 |
| |
| 1) |
西田俊朗、廣田誠一:GIST Educational Book. メディカルレビュー社, 2003 |
| 2) |
Fletcher CD., et al:Diagnosis of gastrointestinal stromal tumors:A
consensus approach. Hum Pathol 33:459-465, 2002 |
| 3) |
Kitamura Y., et al:Gastrointestinal Stromal Tumor(GIST):A model
for moleculebased diagnosis and treatment of solid tumors. Cancer Science 94:315-320,
2003 |
| 4) |
Nakajima M., Toga W.:Tyrosine kinase inhibitor as a therapeutic
drug for chronic myelogenous leukemia and gastrointestinal stromal tumor. Nippon
Yakurigaku Zasshi, 122(6):482-490, 2003 |
| 5) |
Demetri GD., et al:Efficacy and safety of imatinib mesylate
in advanced gastrointestinal stromal tumors. N Engl J Med, 347:472-480, 2002 |
| 6) |
Verweij J., et al:Imatinib mesylate(STI-571 Glivec, Gleevec)
is an active agent for gastrointestinal stromal tumours, but does not yield responses
in other softtissue sarcomas that are unselected for a molecular target. Results
from an EORTC Soft Tissue and Bone Sarcoma Group phase II study. Eur J Cancer,
39:2006-2011, 2003 |
| 7) |
van Oosterom AT., et al:Safety and efficacy of imatinib(STI571)
in metastatic gastrointestinal stromal tumours:a phase I study. Lancet 358:1421-1423,
2001 |
| 8) |
Sattler M., Salgia R.:Targeting c-kit mutations:basic science
to novel therapies. Leuk Res, Suppl 1:11-20, 2004 |
|
| |
2004年6月発行 |

