 |
 |
| 多様化するがん治療のための免疫療法 / はじめに
/ 再発大腸がんに対するがんワクチン療法 / 抗腫瘍性ペプチドアンチネオプラストンを用いた大腸がん肝切除術後の補助療法
/ おわりに |
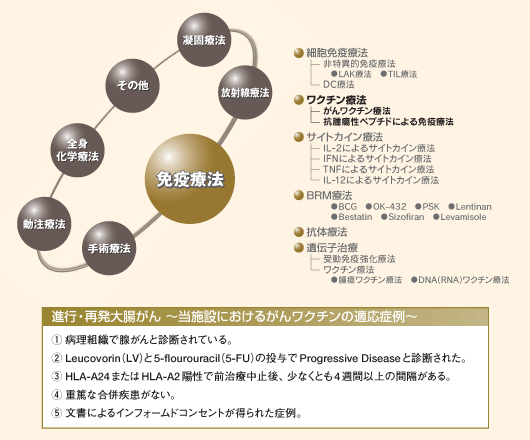
| 多様化するがん治療のための免疫療法 |
| |

 |
| |
▲このページのトップへ |
| はじめに |
| |
再発大腸がんの治療には手術療法、全身化学療法、動注療法、ラジオ波やマイクロ波による凝固療法、放射線療法、免疫療法などがある。再発大腸がんを治癒できる、あるいは長期予後が期待できる手段は手術による病巣の完全切除である。とくに、肝再発や肺再発に対する外科治療の有用性については異論のないところである。しかし、術後の再発は依然高率であり、さらに治療成績を向上させるためには術後補助療法の確立を含めた再発大腸がんに対する総合的な治療戦略の構築が必要である。本稿では、再発大腸がんの治療戦略の一環として最近我々が取り組んでいる新しい治療法を紹介する。 |
| |
▲このページのトップへ |
| 再発大腸がんに対するがんワクチン療法 |
| |
切除不能な再発大腸がんに対する全身療法には抗がん剤を用いた化学療法と免疫療法がある。一般的に免疫療法は副作用が軽微で患者のQOLを低下させずに治療が可能という利点がある。最近、免疫学の進歩により細胞傷害性T細胞(cytotoxic T lymphocyte:CTL)が認識する腫瘍特異抗原の存在が証明され、多くの施設で特異的免疫療法であるがんペプチドワクチンの臨床試験が開始されている。がんワクチンには同定がん抗原を用いたがんワクチン、同定がん抗原を用いないがんワクチンや樹状細胞(DC)を利用したがんワクチンなど種々のものがあるが、 一般的にはCTL応答を惹起するがんワクチンを指すことが多い。
CTLは、がん細胞上のHLA-Class I 分子またはHLA-Class II 分子上に結合する8〜10個のアミノ酸から構成されるペプチド抗原を標的分子(がん抗原分子)として認識し破壊することにより腫瘍免疫の主軸として作用している(図1)。 |
| 図1 がん治療におけるCTL(細胞傷害性T細胞)の役割 |
| |
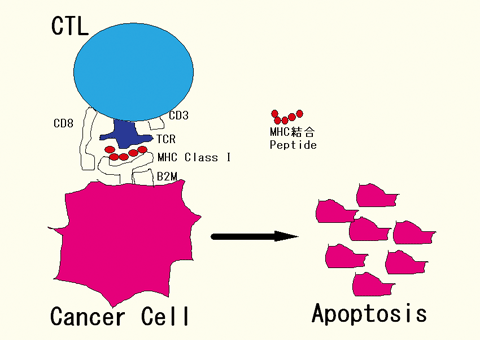

がん細胞上のMHC分子とMHC結合peptideの複合体を認識し、perforin、granzyme
B、Fasリガンド、TRAIL等の分子を誘導し、がん細胞を傷害する。
MHC:主要組織適合抗原(major histocompatibility complex) |
| |
そのようなペプチド抗原をコードする遺伝子(がん拒絶抗原遺伝子)はメラノーマにおいては1991年以降十数種同定され、ペプチド抗原の臨床応用、すなわち、がんワクチンの実用化にむけて欧米を中心に基礎および臨床研究が行われている。その他にwhole cell vaccine、DC vaccine、遺伝子導入などの方法が試みられている。
大腸がんに対するがんワクチン療法の効果に関して、ECOG(Eastern Cooperative Oncology Group)が行ったワクチン療法(放射線照射自己がん細胞とBCG)による術後補助療法の第3相臨床試験では、手術単独群に対しワクチン併用療法群の無病生存期間は良好な傾向 (p=0.0789)を示すことが報告されている1)。
我々の施設の進行・再発大腸がんに対するSART-3ペプチドワクチンの第1相臨床試験では腫瘍縮小効果はみられなかったが、末梢血中のペプチド特異的CTL前駆体の頻度およびHLA-A24拘束性がん特異的CTL前駆体の増加が認められた2)。さらに個々の担がん患者において末梢血中のペプチド特異的CTL前駆体の頻度が異なる点に注目し、担がん患者個々の末梢血中ペプチド特異的CTL前駆体の頻度に基づいたテイラーメイドのがんワクチン療法を大腸がんの進行・再発例に対し2000年10月より施行している。
適応は
| 2. |
Leucovorin(LV)と5-fluorouracil(5-FU)投与でProgressive Diseaseと判断された。 |
| 3. |
HLA-A24またはHLA-A2陽性で前治療中止後、少なくとも4週間以上の間隔がある。 |
| 5. |
文書によるインフォームドコンセントが得られた症例とした。 |
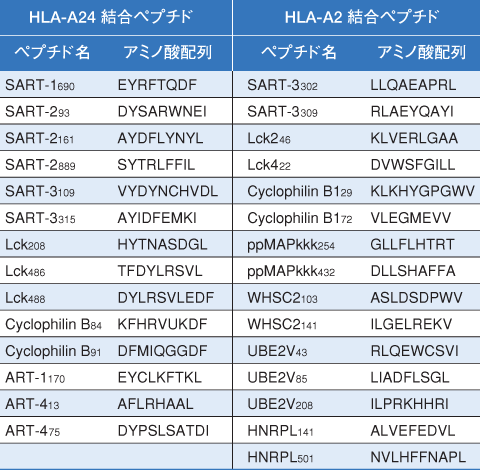
投与ペプチドはHLA-A24または29種類のHLA-A2結合ペプチド(表1)のうち患者末梢血リンパ球(T細胞)と反応するペプチドの中から4種類を選択した。投与方法は不完全フロインドアジュバンドとの各エマルジョン化溶液として大腿部の皮下組織内に2週間に1回投与した。Grade 3以上の有害事象が認められた症例やProgressive Diseaseと判断された場合は中止した。さらにワクチン4回投与後より併用療法としてLVと5-FUを毎週1回点滴静注した。(LVと5-FUは前治療の1/2から1/3の投与量を5週連続投与2週休薬) |
| 表1 当施設で臨床試験に使用しているペプチド |
| |
 |
| |
ペプチドワクチン単独投与では14例中1例にごくわずかにワクチン投与部位近傍の腫瘍縮小が見られたが、抗がん剤LV/5-FUとの併用時には14例中3例に腫瘍の縮小が認められた。末梢血リンパ球中のキラーT細胞前駆体頻度の増加は全例に認められ、投与ペプチドに対し反応するリンパ球の増加に一致して腫瘍縮小および腫瘍マーカーの低下がみられた。有害事象は投与部位の発赤と腫脹のみであった。平均生存期間11.2ヵ月、14例中8例は6ヵ月以上、そのうち4例は1年以上(2例は2年以上)生存している。
現在、他の施設でも樹状細胞とCEA特異的ペプチド、MAGE-3 ペプチド、HER2/neu ペプチド、あるいはmutant p53 epitope ペプチドを用いた臨床試験が進行中であり、がんワクチン療法は切除不能再発がんだけでなく、切除可能な再発がんの術後補助療法としても有用性が期待される。 |
| |
▲このページのトップへ |
抗腫瘍性ペプチドアンチネオプラストンを用いた
大腸がん肝切除術後の補助療法 |
| |
大腸がん肝切除術後の再発は高率であり、治療成績を向上させるひとつの方法は有効な術後補助療法の確立である。本邦では、肝切除後の補助療法として5-FUを用いた肝動注化学療法が積極的に行われてきた。しかし、肝動注は残肝再発抑制効果を示すものの生存率の改善に寄与しないとの問題点が指摘されている。すなわち、肝動注には肝外再発に対する効果が期待できないことから、有効な全身補助療法の併用および単独療法が求められる。
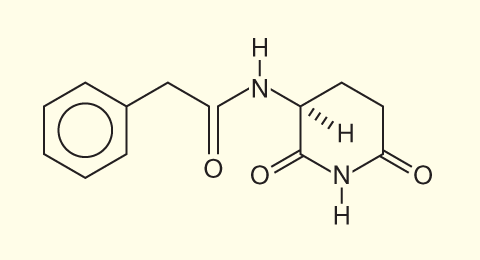
Dr. S. Burzynskiは抗腫瘍活性をもつペプチドをヒトの血中および尿中に発見し、アンチネオプラストン(以下AN)と命名した3)。アンチネオプラストンA10(3-phenylacetylamino-2,6-piperidinedione)はl-glutamine、phenylacetyl chlorideとphenylacetylglutamine(PAG)からなり、分子量は246.15 の白色結晶で水に溶けにくい常温で極めて安定な物質である(図2)。A10は経口的に体内に入ると膵液でPAGとphenylacetylisoglutamine(PAIG)に加水分解され、さらにphenylacetate(PA)に代謝される。BurzynskiはPAGとPAIGを4:1に配合したA10 injection formulation(A10-I)、さらにPAGとPAを1:4で混じた経口剤AS2-1を化学合成し、がん治療に臨床応用している。当院で行われた第1相臨床試験では、A10-I およびAS2-1による有害事象は、手指のこわばりや腹部膨満感など極めて軽微であることが確認された。ANの抗腫瘍機序として分化誘導や正常化作用に加え、筆者らはG1細胞休止作用、アポトーシス誘導作用および脱メチル化作用(メチル化の正常化)を明らかにしてきた4)。 |
| 図2 A10(3-phenylacetylamino2,6-piperidinedione)の構造式 |
| |
 |
| |
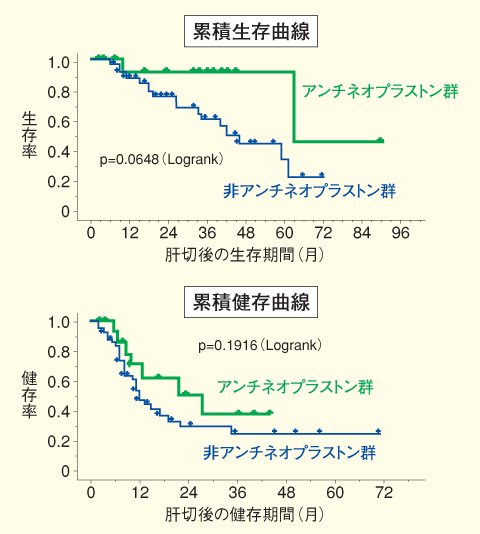
教室ではANの抗腫瘍効果と極めて軽微な毒性に着目し、1994年より大腸がん肝切除症例に対して肝動注(総量15gの5-FUを持続または間歇投与)にA10-I 30〜100g/dayを持続点滴投与、7〜10日間)、AS2-1(10g/dayを経口で1年以上)の全身投与を付加した補助療法を施行している5、6)。ANの評価は、1998年より開始した無作為比較試験(64例)の結果を待たなければならないが、historical controlとの比較では生存率は良好である(図3)5)。AN群の生存率が良好な理由は、再発の程度が軽く再切除など外科的治療が高率に施行可能であったためと考えられる。さらに、本剤の抗腫瘍作用を考えると腫瘍の生物学的特性を修飾することによる腫瘍増殖活性の低下や生存期間の延長効果が期待される。 |
| 図3 アンチネオプラストン投与の有無別生存曲線および健存曲線 |
| |
 |
| |
ANはその毒性の低さから、進行・再発大腸がんに有効とされるイリノテカンやオキザリプラチン+LV/5-FUの強力な化学療法にも十分併用可能と考えられ、今後大腸がん肝・肺切除後の補助療法として強力な化学療法との併用に期待したい。 |
| |
▲このページのトップへ |
| おわりに |
| |
再発大腸がんに対し、我々が行っているがんワクチン療法と抗腫瘍性ペプチドアンチネオプラストン療法について述べた。これらの治療法は極めて毒性が低く、患者のQOLを保った状態で治療が継続でき、また化学療法との併用も可能である。切除不能な再発大腸がんあるいは切除後の補助療法として、これら治療法を取り入れた再発大腸がんに対する治療戦略の構築が可能と思われる。 |
| |
▲このページのトップへ |
| 参考文献 |
| |
| 1) |
Harris JE, Ryan L, Hoover HC, et al.:Adjuvant active specific
immunotherapy for stage II and III colon cancer with an autologous
tumor cell vaccine:Eastern Cooperative Oncology Group Study E5283.
J Clin Oncol, 18:148-157, 2000 |
| 2) |
Miyagi Y, Sasatomi T, Shirouzu K, et al.:Induction of cellular immune
responses to tumor cells and peptides in colorectal cancer patients by
vaccination with SART-3 peptides. Clin Cancer Res, 7:3950-3962,
2001 |
| 3) |
Burzynski SR:Antineoplastons:biochemical defense against cancer.
Physiological Chemistry&Physics, 8:275-279, 1976 |
| 4) |
Matono K, Ogata Y, Tsuda H, et al.:Effects of antineoplaston AS2-1
against postoperative lung metastasis in orthotopically implanted colon
cancer in nude rat. Oncol Rep, 13:389-395, 2005 |
| 5) |
緒方 裕,的野敬子,平城 守ほか:大腸癌肝転移に対する肝切除後補助
療法としての生化学的抗腫瘍剤アンチネオプラストン投与.臨床と研究,
78:2099-2102, 2001 |
| 6) |
Ogata Y, Tsuda H, Matono K, et al:Long-term survival following
treatment with antineoplastons for colon cancer with unresectable
multiple liver metastases : Report of a Case. Surgery Today, 33:
448-453, 2003 |
|
| |
2005年6月発行 |

