The European Cancer Congress 2013 - ESMO


我々が従来認識していたKRAS 遺伝子変異といえば、codon 12, 13 (exon 2) 変異のみであったが、本年の米国臨床腫瘍学会において、Panitumumabを用いた3つの試験 (PEAK試験、PRIME試験、20020408試験) よりKRAS exon 3, 4、NRAS 変異を加えた「全てのRAS 野生型」でさらに有効症例が絞り込まれることが報告されたのは記憶に新しいところである。また、本会においてもFIRE-3試験で同様の結果が報告され、全てのRAS 遺伝子変異測定の必要性は揺るぎないものとなった。
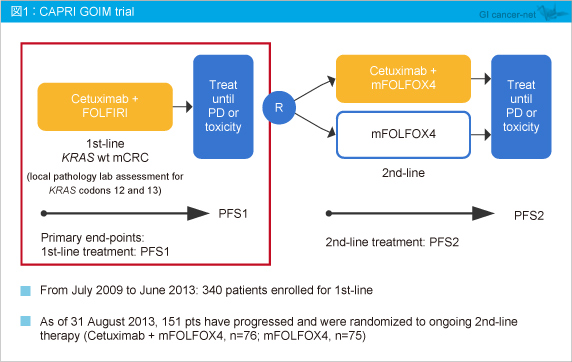
CAPRI GOIM試験は試験登録後、FOLFIRI + Cetuximabで1st-lineを導入し、増悪/毒性中止となった後にmFOLFOX4もしくはmFOLFOX4 + Cetuximab療法に無作為割付けする試験であるが、今回は次世代シークエンスの1つであるIon AmpliSeqTM 法を用いた22種類の遺伝子変異解析結果を用いて、1st-line部分の有効性を評価している。
22種類の遺伝子のうち、KRAS /NRAS を合わせた「全てのRAS 変異型」では奏効率およびPFS (progression-free survival) は不良であり、上述の報告を支持する結果であった。
また、本試験へは各参加施設で測定したKRAS exon 2野生型の結果を基に登録されていたが、今回のIon AmpliSeqTM 法を用いて再度、KRAS exon 2の変異検索を行ったところ、評価を行った182例中30例 (16.5%) のKRAS exon 2変異型が含まれていたことも特筆に値する。今回のIon AmpliSeqTM 法は変異検出感度2%であり、検出感度の違いによることが想定される結果であった。
本試験の結果は、全てのRAS 遺伝子変異測定の必要性を再認識させ、また高感度法での全てのRAS 遺伝子測定の重要性も痛感させられる結果であった。
抗EGFR抗体薬と化学療法の併用は、KRAS exon 2野生型の切除不能進行・再発大腸癌に対する1st-lineとして有益である。本年、PRIME試験およびPEAK試験においてKRAS /NRAS exon 2, 3, 4野生型症例におけるFOLFOX4 + Panitumumabの有効性が示された。CPT-11 + Cetuximabにおけるレトロスペクティブ解析においても同様な結果が示されているが1)、現時点で1st-lineのFOLFIRI + CetuximabにおけるKRAS exon 3, 4およびNRAS exon 2, 3, 4変異に対する有効性を検証した臨床試験成績は報告されていない。また、1st-lineにおいて、種々の遺伝子変異ならびに変異の複合が抗EGFR抗体薬の有効性にどのように影響するかを検討した臨床試験成績も報告されていない。
CAPRI GOIM試験では、1st-lineでFOLFIRI + Cetuximabによる治療を受けた、KRAS exon 2野生型の切除不能進行・再発大腸癌患者を対象に、2nd-lineにおけるFOLFOX ± Cetuximabの有効性および安全性を検討した。今回は、1st-lineにおける遺伝子変異の有無別による有効性の解析結果が報告された。
対象は、1st-lineでFOLFIRI + Cetuximabによる治療を受けたKRAS exon 2 (codon 12, 13) 野生型の切除不能進行・再発大腸癌患者であり、2009年7月〜2013年6月の間に1st-lineとして340例が登録され、2013年8月31日時点で151例が増悪し、mFOLFOX4 ± Cetuximabによる2nd-lineへと移行した (図1) 。主要評価項目は1st-lineにおけるPFS (PFS1) 、および2nd-lineにおけるPFS (PFS2) とした。
KRAS exon 2野生型の確認は主治医の元で実施されたが、その後の遺伝子変異の解析は、腫瘍標本を集積して次世代シークエンスであるIon AmpliSeqTM を用いた。Ion AmpliSeqTM は少量のDNA (10ng) で数百ヵ所の変異を迅速に解析可能であり、今回はIon AmpliSeqTM Colon and Lung Cancer Panelにより22種類の遺伝子 (KRAS , EGFR , BRAF , PIK3CA , AKT1 , ERBB2 , PTEN , NRAS , STK11 , MEK1 , ALK , DDR2 , CTNNB1 , MET , TP53 , SMAD4 , FBXW7 , FGFR3 , NOTCH1 , ERBB4 , FGFR1 , FGFR2 ) について変異の有無を評価した。なお、KRAS はexon 2, 3, 4、NRAS はexon 2, 3、BRAF はexon 11, 15、PIK3CA はexon 9, 13, 20を解析している。
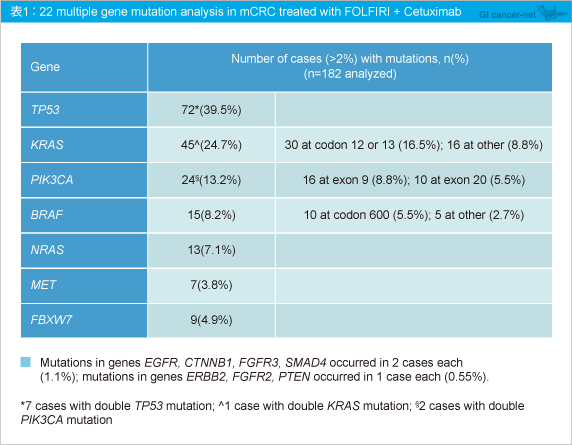
1st-lineに登録された340例のうち182例 (53.5%) が22種類の遺伝子を解析された。182例中124例 (68.1%) に1つ以上の変異が認められ、合計206の遺伝子変異が認められた。なお、遺伝子変異が認められたのは22種類中14種類であった。
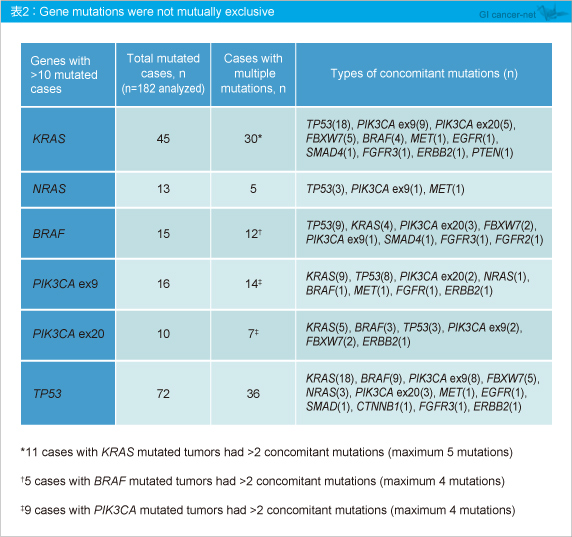
最も変異が多かったのはTP53 であり、次いでKRAS 、PIK3CA 、BRAF 、NRAS と続いた (表1) 。なお、KRAS exon 2 (codon 12, 13) 変異が30例 (16.5%) に認められた。遺伝子変異が重複した症例も存在し、TP53 変異を有する症例で他の遺伝子変異との重複が多く確認された (表2) 。
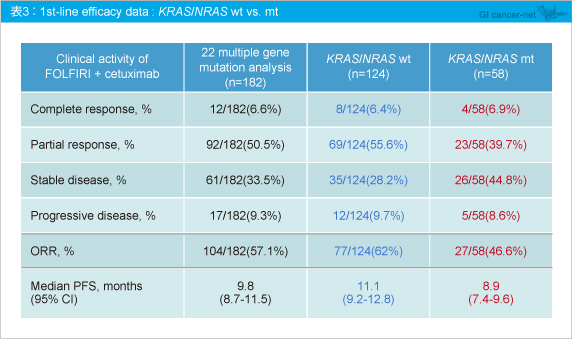
ITT解析 (KRAS exon 2野生型340例) と遺伝子変異解析例 (182例) における腫瘍縮小効果は同程度であったが、KRAS /NRAS 野生型の奏効率は62%、KRAS /NRAS 変異型は46.6%であった。また、PFS中央値はそれぞれ11.1ヵ月、8.9ヵ月であり、いずれもKRAS /NRAS 野生型症例で有効性が優れることが示された (表3) 。
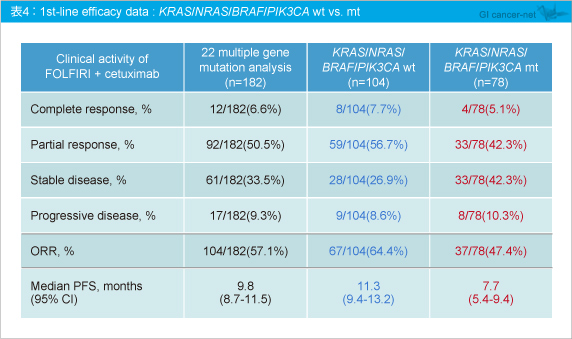
なお、KRAS /NRAS にBRAF 、PIK3CA を加えた解析では、奏効率は野生型64.4%、変異型47.4%、PFS中央値はそれぞれ11.3ヵ月、7.7ヵ月と、その差はより大きくなった (表4) 。
CAPRI GOIM試験の1st-lineにおけるITT解析の奏効率は56.4%、PFS中央値は9.9ヵ月であり、CRYSTAL試験 (奏効率57.3%、PFS中央値9.9ヵ月) 2) と同様の結果であった。
Ion AmpliSeqTM 法による遺伝子解析により、事前の検査でKRAS exon 2野生型とされた182例中30例にKRAS exon 2変異が検出された。また、182例中124例に何らかの遺伝子変異があり、22種類中14種類の遺伝子変異が計206検出された。
KRAS /NRAS 野生型症例よりも、KRAS /NRAS /BRAF /PIK3CA 野生型症例でFOLFIRI + Cetuximabの有効性が高い傾向にあることから、KRAS /NRAS 以外の遺伝子変異を評価することで、より有益な治療効果が得られる症例を判別することができる可能性がある。


