| | |||||||||||||||||||||||||||||||
| 症例1 | |||
| 68歳・女性 大腸内視鏡検査により横行結腸に全周性腫瘍を、CT検査により肝転移を認める。 貧血、けいれん性の腹痛あり。 |
|||
| 【治療戦略を考える上でのポイント】 | |||
| (1) 切除可能 vs. 切除不能 (2) ネオアジュバント vs. palliative therapy (3) 奏効率 vs. PFS/OS (4) 積極的な治療 vs. QOLの維持 (5) 治療の順序 |
|||

Peeters:上記の症例のように大腸内視鏡検査で腫瘍を認め、CT検査で肝転移が検出された場合、我々がまず考えなくてはならないポイントは、「原発巣および転移巣は切除可能か、それとも切除不能か」ということです。次に検討すべきは「治癒を目指してネオアジュバントまたは導入療法を行うべきか、それともpalliative therapyを行うべきか」であり、前者であれば奏効率が、後者であればprogression-free survival(PFS)とoverall survival(OS)が重要になります。
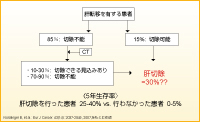
肝転移を有する場合、肝転移の切除ができるかどうかで生存は大きく異なります。肝転移切除を行った患者の5年生存率は25〜40%であるのに対し、切除を行わなかった患者では5%程度に過ぎません2)(図1)。肝転移を有する患者の85%は、診断時点では肝転移の切除は不能ですが、そのうち10〜30%は切除に持ち込める可能性があります2)。
次のポイントは、「積極的な治療をするか、QOLの維持に重点を置くべきか」ということです。積極的な治療よりも、QOLに焦点を合わせなければならない場合もあるでしょう。例えば、PSが非常に悪い患者などでは、最初からbest supportive care(BSC)を考慮しなければなりません。
治療の順序についても、原発巣と転移巣の診断がついた時点で手術をするか、それとも化学療法を行ってから手術をするか、多くの議論があります。現在もなお、進行再発大腸癌の治療の中心は5-FU系薬剤とIrinotecan(CPT-11)またはOxaliplatin(L-OHP)の併用です。FOLFIRIとFOLFOXのどちらを1st-lineにしても、最終的には20ヵ月以上のOSが得られますから3)、化学療法の順序はそれほど重要ではありません。ここで重要なのは毒性です。ご存知の通り、L-OHPを一定期間使用すると、末梢神経障害が問題となります。もう1つの重要な点は奏効率であり、2nd-lineにはFOLFOXのほうが、FOLFIRIよりも優れていると報告されています3)。
2004年には血管新生を標的にした抗VEGF抗体のBevacizumabが導入され、現在は抗EGFR抗体も使用できるようになりました。その他、アポトーシスやインスリン様増殖因子(IGF)受容体をターゲットとした新薬の研究も進行中ですが、数年以内に実臨床への導入が可能と考えられる薬剤はありません。
抗EGFR抗体は単剤でも有効ですが、抗VEGF抗体は化学療法と併用した場合にのみ有効です。抗VEGF抗体の開発は1st-line、2nd-line、術後補助化学療法という順で進められました。術後補助化学療法の大規模臨床試験には、米国のNSABP C-08試験、欧州のAVANT試験の2つがありますが、NSABP C-08試験の結果はnegativeでした4)。現在、AVANT試験の結果待ちですが、こちらもおそらくnegativeではないかと思われます。
一方、抗EGFR抗体の大規模臨床試験は、既存の化学療法に抵抗性の患者を対象にして行われ、2nd-line以降から1st-line、そして術後補助化学療法という順で進められています。
PRIME試験は、化学療法歴のないKRAS野生型患者においてFOLFOXへのPanitumumabの上乗せ効果を検討した大規模第III相臨床試験です。KRAS野生型に対する抗EGFR抗体のエビデンスには、CRYSTAL試験(FOLFIRI±Cetuximab)5-6)、OPUS試験(FOLFOX±Cetuximab)7)があり、いずれもKRAS測定率は高いのですが、プロスペクティブに測定しているのはPRIME試験だけです(表1)。
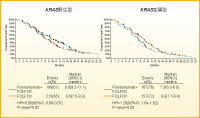
KRAS野生型におけるPFS中央値はFOLFOX+Panitumumab群が9.6ヵ月、FOLFOX群は8.0ヵ月で、Panitumumabの上乗せによる有意なPFSの延長が認められました(HR=0.80, p=0.02/図2)8)。また、OS中央値は23.9ヵ月 vs. 19.7ヵ月(HR=0.83, p=0.072)と、Panitumumab併用群で優れた傾向にありました。
一方、KRAS変異型のPFS曲線は、KRAS野生型とは反対に、Panitumumab併用群のほうが下回りました。つまり、KRAS変異型に対してはFOLFOXにPanitumumabを追加すると悪影響があるということで、OPUS試験と同様の結果になっています。したがって、現在のデータからは、KRAS変異型患者に抗EGFR抗体を併用すべきではないといえます。
奏効率については、KRAS野生型のFOLFOX+Panitumumab群では55%、FOLFOX単独群では48%で有意差は得られませんでしたが、これはFOLFOX単独群の奏効率が過去の報告よりも高いことが影響していると考えられます。なお、変異型ではいずれの群も40%と差はありませんでした。
PRIME試験とCRYSTAL試験、OPUS試験の結果を比較すると、奏効率およびPFS中央値については大きな差はありません(表1)。OSにおける群間差はPRIME試験では4.2ヵ月、CRYSTAL試験では3.5ヵ月です。一方、PanitumumabとBevacizumabのデータを比較すると、奏効率はFOLFOX+PanitumumabのほうがFOLFOX+Bevacizumabよりも若干良好であり(表2)、PFSとOSについては大差ありません8-9)。したがって、1st-lineにおけるPanitumumabおよびCetuximab、Bevacizumabの標準化学療法との併用による有効性は、ほぼ同等と考えられます。