| | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 症例2 | |||
| 35歳・男性 | |||
| 【家族歴】 | |||
| 二等親に51歳で結腸癌 | |||
| 【臨床症状】 | |||
| 2004年 同 同 同 |
1月 4月 9月 10月 |
:非定型的な腹部症状 :腸管出血 :右季肋部痛、倦怠感 :便秘、発熱、体重減少 |
|
| 【検査所見】 | |||
| ・大腸内視鏡検査と生検によりS状結腸腺癌(G2)を認める ・CT検査によりびまん性の肝転移を認める ・CEA:14,507ng/mL |
|||
| 【治療歴】 | |||
| 1st-line:FOLFOX6+Bevacizumab →10ヵ月後にPD 2nd-line:FOLFIRI →4ヵ月後にPD |
|||
| 【治療戦略を考える上でのポイント】 | |||
| (1) Best supportive care vs. 治療によるコントロール (2) 単剤 vs. 併用療法 (3) QOLを最重視 (4) 患者の利便性 |
|||
Peeters:二次治療でもPDとなった場合、我々がまず考慮すべきは「この状況で施行可能な治療法はあるか、それともBSCか」ということです。治療を行う場合は、「単剤か併用療法か」を選択しなければなりません。この段階では、QOLと患者の利便性が極めて重要になります。
以上のポイントを、具体的な症例に基づいて考えてみたいと思います。症例は35歳の男性で、非定型的な腹部症状により受診しました。大腸内視鏡検査と生検でS状結腸腺癌を認め、CT検査ではびまん性の肝転移を認めました。CEAは14,507ng/mlときわめて高値です。FOLFOX6+Bevacizumab療法を行ったところCEAは低下し、CT上でも著明な改善が認められました。しかし10ヵ月後にPDとなったため、FOLFIRI単独療法に切り換えましたが、4ヵ月後にPDとなりました。
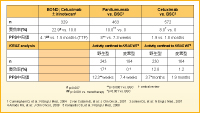
問題は、我々がこの若い患者さんに対し、次にどのような方法を選ぶべきかということです。さまざまなパラメータを併せて検討する必要があると思います。例えば、利用できる有効な薬剤、毒性、QOL、そして患者側の要因(PS、利便性、コンプライアンスなど)を同時に考えなければなりません(表5)。
3rd-lineおよび4th-lineでの抗EGFR抗体のデータ(表6)をみると、BOND試験では、少数例でCetuximab±CPT-11を行ったときの奏効率が、Cetuximab+CPT-11群22.9% vs. Cetuximab単剤群10.8%と、併用群で良好な成績が得られています12)。PanitumumabとBSCのクロスオーバー試験13)やCetuximabとBSCを比較したNCIC CTG CO.17試験14)でも、奏効率が0%から8〜10%に、KRAS野生型患者に限れば12.8〜17%にまで増加します15-16)。
ここで問題となるのは、「3rd-line以降の治療において、奏効率はそれほど重要であるか」ということです。しかし、3rd-lineにおける奏効率が17%15)というのは例がなく、一概に「3rd-lineでは奏効率は重要でない」とは言い切れません。
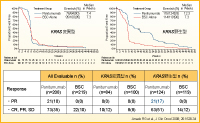
PanitumumabとBSCのクロスオーバー試験では、KRAS野生型に限ると、PFSおよび奏効率の両方でベネフィットがみられます(図4)15)。この点も重要で、PRおよびSDの患者 ではPFS中央値も少し延長されますが(それぞれ27週間、23.9週間)、PDの患者では7.3週間に過ぎません。したがって、初回評価で奏効が認められた場合、その患者さんにとってPanitumumabはおそらく有用であるといえます。
なお、皮膚毒性の程度と発現頻度は、PanitumumabとCetuximabで大きな差はありません。