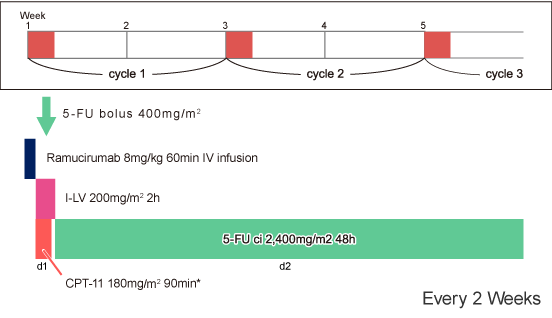
FOLFIRI+Ramucirumab
 |
|
*CPT-11の日本での承認用量は150mg/m2 |
Tabernero J, et al.: Lancet Oncol. 16(5): 499-508, 2015 |
Ramucirumabは、VEGFファミリーの受容体であるVEGFR-2の細胞外ドメインに結合し、VEGF-A, C, DのVEGFR-2への結合を阻害する完全ヒト型IgG1モノクローナル抗体薬である。2015年3月に「治癒切除不能な進行・再発の胃癌」の適応で承認されると、2016年5月には「治癒切除不能な進行・再発の結腸・直腸癌」の適応追加の承認を受けた。さらに、2016年6月には「切除不能な進行・再発の非小細胞肺癌」の適応追加の承認を受けている。
◆RAISE試験
1st-lineとしてBevacizumab、Oxaliplatin、フッ化ピリミジン系製剤を投与された切除不能進行・再発大腸癌患者におけるFOLFIRIへのRamucirumabの上乗せ効果を検証する国際多施設共同第III相試験が行われた1)。
適格症例1,072例が、FOLFIRI+Ramucirumab群とFOLFIRI+プラセボ群に1:1の割合で無作為化された。
■有効性
主要評価項目であるOS中央値は、FOLFIRI+プラセボ群11.7ヵ月、FOLFIRI+Ramucirumab群13.3ヵ月であり、Ramucirumab併用により有意な延長を認めた(p=0.0219)。また、副次評価項目であるPFS中央値は、FOLFIRI+プラセボ群4.5ヵ月、FOLFIRI+Ramucirumab群5.7ヵ月であり、Ramucirumab併用により有意な延長を認めた(p=0.0005)。
サブグループ解析では、1st-lineの病勢進行までの期間6ヵ月以上/6ヵ月未満、KRAS野生型/変異型、男性/女性、65歳未満/65歳以上、白人/アジア人など、すべてのサブグループにおいて、OS、PFSともにFOLFIRI+Ramucirumab群で良好であった。
| FOLFIRI+Ramucirumab群 (n=536) |
FOLFIRI+プラセボ群 (n=536) |
HR (95% CI) |
P値 | |
| OS中央値 | 13.3ヵ月 | 11.7ヵ月 | 0.844 (0.730-0.976) |
0.0219 |
| PFS中央値 | 5.7ヵ月 | 4.5ヵ月 | 0.793 (0.697-0.903) |
0.0005 |
■安全性
Grade 3以上の治療関連有害事象は、FOLFIRI+プラセボ群62%、FOLFIRI+Ramucirumab群79%であったが、この差は主にgrade 3によるものであり、grade 4(それぞれ14%、17%)、死亡(ともに4%)は両群で同程度であった。FOLFIRI+Ramucirumab群で5%以上に発現したgrade 3以上の治療関連有害事象は、好中球減少(38%)、疲労(12%)、高血圧(11%)、下痢(11%)であり、下痢および疲労の頻度は両群で同程度であった。Grade 3以上の好中球減少はFOLFIRI+Ramucirumab群で高率であったが(23% vs. 38%)、発熱性好中球減少症の頻度は低く、両群で同程度であった(全gradeで3% vs. 4%)。高血圧は、全grade(9% vs. 26%)、grade 3以上(3% vs. 11%)のいずれもFOLFIRI+Ramucirumab群で多くみられた。全gradeの蛋白尿はFOLFIRI+Ramucirumab群で多かったが(5% vs. 17%)、grade 3以上は1%以下であった。静脈血栓塞栓症、infusion reactionの頻度は低く、両群で同程度であった。
Reference
- 1) Tabernero J, et al.: Lancet Oncol. 16(5): 499-508, 2015
- 副作用対策講座「下痢」
GI cancer-net
消化器癌治療の広場
