FOLFIRI+Aflibercept
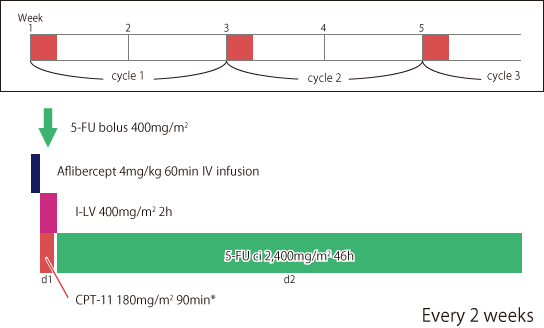 |
|
*CPT-11の結腸・直腸癌における国内承認用量は150mg/m2である。ただし、投与量は、年齢、症状により適宜増減する。 |
Van Cutsem E, et al.: J Clin Oncol. 30(28): 3499-3506, 2012 |
Afliberceptは、VEGFR-1, -2の細胞外ドメインの一部をヒトIgG1のFc領域に融合させた組換え融合蛋白質である。VEGF-A、VEGF-B、PLGFに結合することでVEGFR-1, -2への結合を阻害し、腫瘍における血管新生を阻害するとされている。
オキサリプラチン不応・不耐例を対象とした第III相試験(VELOUR試験)において、2次治療としてのFOLFIRIに対するFOLFIRI+Afliberceptの優越性が検証された1)。
2017年3月に「治癒切除不能な進行・再発の結腸・直腸癌」の効能・効果で厚生労働省より製造販売承認を取得した。
◆VELOUR試験
Oxaliplatin不応の切除不能進行・再発大腸癌患者における2nd-lineとしてのFOLFIRI+プラセボ(プラセボ群、n=614)に対するFOLFIRI+Aflibercept(Aflibercept群、n=612)の優越性を検証した第III相試験である。
■有効性
観察期間中央値は22.3ヵ月であった。主要評価項目であるOSは、Aflibercept群の中央値13.5ヵ月、プラセボ群の中央値12.1ヵ月であり(HR 0.82、p=0.0032)、Aflibercept群で有意に良好であった。
副次的評価項目(Aflibercept群/プラセボ群)であるPFSは、中央値6.9/4.7ヵ月(HR 0.76、p=0.0007)、奏効割合は19.8/11.1%(p=0.0001)であり有意にAflibercept群で良好であった。
Bevacizumab投与歴によるサブグループ解析では、OS中央値(Aflibercept群/プラセボ群)は、Bevacizumab投与歴あり(各群の30%の症例)で12.5/11.7ヵ月、Bevacizumab投与歴なしで13.9/12.4ヵ月であり、Bevacizumab投与歴の有無に関わらずAfliberceptの上乗せ効果が示唆された。
| FOLFIRI+Aflibercept (n=530) |
FOLFIRI+プラセボ (n=531) |
HR (95% CI) |
P値 | |
| OS | 13.5ヵ月 | 12.1ヵ月 | 0.817 (0.71-0.94) |
0.0032 |
| PFS | 6.9ヵ月 | 4.7ヵ月 | 0.758 (0.66-0.87) |
0.0007 |
| 奏効割合 | 19.8% | 11.1% | − | 0.0001 |
■安全性
Aflibercept群でより高頻度に認められたgrade 3以上の有害事象(Aflibercept群/プラセボ群)は、下痢(19/8%)、口腔粘膜炎(14/5%)、好中球減少(37/30%)、感染(12/7%)、高血圧(19/2%)、蛋白尿(8/1%)などであり、有害事象に伴う治療中止例(27/12%)は、Aflibercept群で高頻度であった。
本邦では、VELOUR試験と同じ対象にFOLFIRI+Afliberceptの第II相試験(n=62)が施行され、日本人における有効性(奏効割合8%、PFS中央値5.4ヵ月、OS中央値15.6ヵ月)と安全性(grade 3以上の有害事象:好中球減少61%、下痢19%、口腔粘膜炎8%)が確認された2)。
レジメン解説執筆:愛知県がんセンター中央病院 薬物療法部 加藤 恭子 先生/舛石 俊樹 先生
References
- 1) Van Cutsem E, et al.: J Clin Oncol. 30(28): 3499-3506, 2012[PubMed]
- 2) Satoh T, et al.: J Clin Oncol. 35, 2017 (suppl 4S; abstract 707)
- 副作用対策講座「下痢」
GI cancer-net
消化器癌治療の広場
