| |
●2014年改定予定の国内ガイドラインにおける予想
吉野:海外のガイドラインを踏まえ、今後の日本のガイドラインについて、ガイドライン作成委員である室先生からお話しいただきます。
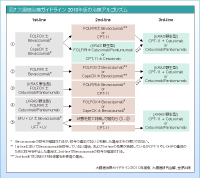
室:日本の大腸癌治療ガイドラインは2010年版では、図7のような治療アルゴリズムが掲載され、2014年1月には新しいガイドラインが発表されることになっています。大腸癌研究会のホームページには、2010年以降のガイドラインに追記すべき最新情報が順次更新されて、全身化学療法に関しては3つの試験について記載されています。
第1の試験は2010年に発表された、2nd-lineのFOLFIRIに対するIRIS療法の非劣性が証明されたFIRIS試験。第2の試験は2013年に発表された、1st-lineで増悪を認めた後のBevacizumabの継続使用 (Bevacizumab beyond progression: BBP) の有効性が認められたTML試験。そして第3の試験がRegorafenibのCORRECT試験です20)。これらは、ほぼ間違いなく2014年版のガイドラインに掲載されるでしょう。特にRegorafenibは、日本においてもKRAS 野生型であれば4th-line、変異型では3rd-lineでの使用が推奨されると推察されます。
CORRECT試験に関するガイドライン委員会のコメントでは、「本剤の使用に当たっては、その主たる効果は病状の安定化 (奏効率1%、病状安定化率41%) であり、生存期間中央値の差は1.4ヵ月であることを考慮に入れておく必要がある」と明記しています。HRが0.77と明らかなOSの延長が示された反面、OS中央値は1.4ヵ月の延長に過ぎません。さらに、KRAS statusの影響を受けないというメリットがありますが、サブグループ解析では日本人においてgrade 3以上の手足症候群の頻度が高く、1コース目から出現していることを注意事項として挙げており、早期の適切な対応が重要であると述べています。
つまり、適切な対象患者に、適切な毒性マネジメントを施して治療を行うべきであるという位置づけになっています。
吉野:添付文書上の適応はどのようになっていますか。

室:効能・効果は「治癒切除不能な進行・再発の結腸・直腸癌」ですが、使用上の注意として「1st-lineおよび2nd-lineにおける有効性・安全性は確立していない」と記載しており、基本的には3rd-line以降での使用になります。
吉野:これまでわれわれが実施してきた標準治療をしっかり行い、増悪や毒性中止になった症例に適用するということですね。
室:それに加えて、全身状態が良好な症例に投与するべき薬剤です。
吉野:NCCNやESMOのガイドラインに極めて近いものになりそうですね。日本のガイドラインでも、Regorafenibはやはりline後半を固める薬剤ということでした。


 |