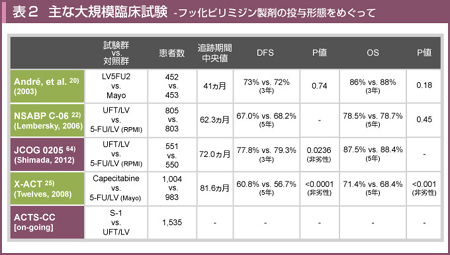
1990年代に相次いで報告された大規模臨床試験により、5-FU/LVが結腸癌の術後補助化学療法の標準治療となったが、その投与量やスケジュールはさまざまであった2)。5-FU/LVの投与法に端を発したフッ化ピリミジン製剤のoptimalな投与形態をめぐる検討は、現在も続いている (表2)。
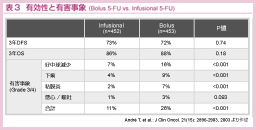
5-FU/LVの投与法には、米国を中心とする5-FU静注 (bolus 5-FU) と、欧州を中心とした5-FU持続静注 (infusional 5-FU) がある。切除不能大腸癌に対するメタアナリシスでは、奏効率およびOS、血液毒性において、infusional 5-FUのほうが優れているとの報告がある19)。
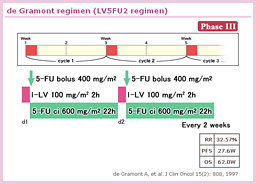
一方、治癒切除結腸癌については、フランスのGERCORにより、stage II/ III (Dukes’ B/ C) に対するde Gramont レジメン (LV5FU2: infusional 5-FU) vs. Mayoレジメン (bolus 5-FU) の無作為化比較試験が実施された。その結果、予後に差はないものの、毒性は明らかにinfusional群が良好であることが報告された20)(表3)。したがって、結腸癌の術後補助化学療法としての5-FU/LVの投与法は、LV5FU2が最適と考えられた。
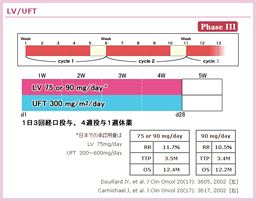
わが国で大腸癌治療に用いられている経口フッ化ピリミジン製剤の補助療法としての効果は、坂本らのメタアナリシスにより、DFSについては明らかに有意に (HR=0.85, 95% CI: 0.77-0.93, P <0.001)、またOSについてもボーダーラインではあるが有意に (HR=0.89, 95% CI: 0.80-0.99, P=0.04) 治癒切除後の大腸癌の予後を改善することが報告されている21)。
NSABP C-06試験は、stage II/ III結腸癌に対して、UFT/LVと5-FU/LV (RPMIレジメン) を比較した試験である。全体の5年生存率はUFT/LV群で78.5%、5-FU/LV群では78.7%と同等であった。Stage IIではUFT/LV群が88.4%、5-FU/LV群では87.0%と差がなく、stage IIIでもUFT/LV群が69.6%、5-FU/LV群では71.5%であり、UFT/LVと5-FU/LVの同等性が認められた22)。
本邦においても、stage III治癒切除後の大腸癌 (結腸癌およびRS癌、Ra癌) 1,101例を対象としたJCOG 0205試験 (UFT/LV vs. RPMIレジメン) が行われ、ASCO 2012で長期予後が発表された。3年DFSは、5-FU/LV群79.3%、UFT/LV群77.8%と非劣性が示された (HR=1.016, 91.3% CI:0.838-1.232, p=0.0236) 64)。 Grade 3/4の有害事象については、5-FU/LV群では好中球減少 (8.4%) 、UFT/LV群ではALT上昇 (8.7%) が高値であり、下痢 (9.6%, 8.5%) 、食欲不振 (4.0%, 3.7%) の発現頻度は同等であった。別試験の直接比較は乱暴ではあるが、JCOG0205試験における5年OSは87.5%であり、NSABP C-06試験 (69.6%) と比較して良好であった22)。これは、D3郭清の実施および細かなリンパ節検索によるupstagingが理由と考えられた。
また、JFMC33-0502試験の3年DFSがESMO 2012で発表された。この試験では、治癒切除後の大腸癌 (stage IIB/IIIの結腸癌、RS癌) 1,071例を対象に、術後補助化学療法としてのUFT/LV経口療法の至適な治療スケジュールについて、連日投与法 (day 1-28, 5週毎) で6ヵ月投与する標準治療群と、5投2休法 (day 1-5, 5週毎: 土日休薬) で18ヵ月投与する試験治療群とが検討された。3年DFSは標準治療群73% (95% CI: 0.69-0.77) 、試験治療群74% (95% CI: 0.70-0.77) と、有意な差は認められなかった (p=0.84) 65)。
一方、stage IIに対する術後補助化学療法に関しては、明確な試験結果は現状では報告されていない。このため本邦において、再発危険因子 (T4、穿孔・穿通、低分化腺癌、粘液癌、郭清リンパ節個数12個未満) を有するstage II大腸癌に対してUFT/LV療法の臨床的有用性を検討するJFMC46-1201試験の症例集積が開始された66)。
X-ACT試験24, 25)は、Capecitabineと5-FU/LV (Mayoレジメン) の無作為化比較試験である。同試験の特徴は、対象がstage IIIに限定されていることである。5年OSはCapecitabine群で71.4%、5-FU/LV群では68.4%であり、Capecitabine群が3%上回り、Capecitabineの5-FU/LVに対する同等性が示された25)。
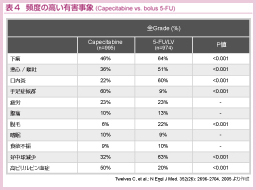
有害事象に関しては、Capecitabine群では好中球減少の頻度が低い一方、手足症候群の頻度は高く、5-FU/LVとの有害事象のプロファイルの違いが注目される (表4)。
ACTS-CC試験は、stage III結腸癌 (RS癌含む) の術後補助化学療法として、標準治療の1つであるUFT/LV療法に対するS-1療法 (1日2回経口投与, 4週投与2週休薬, 6ヵ月間) の非劣性を検証する無作為化比較試験である。2009年6月に1,535例を以て登録を終了しており、今後、S-1の補助化学療法としての位置づけが示される試験となるであろう。
GI cancer-net
消化器癌治療の広場