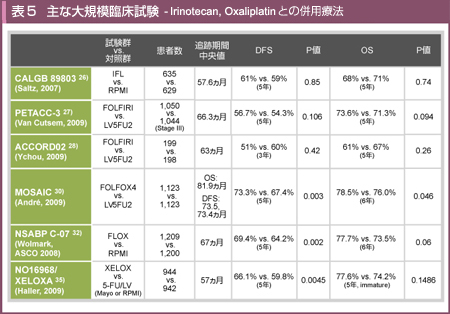
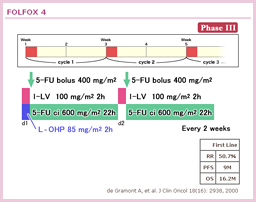
切除不能大腸癌における数々の臨床試験により、Irinotecan、Oxaliplatinといった新しい殺細胞性抗癌剤との併用療法の有用性が示されたことから、アジュバントにおいても両薬剤との併用療法を検証する臨床試験が行われた5) (表5)。
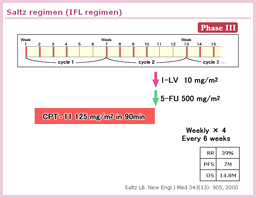
Stage III結腸癌1,264例を対象としたCALGB 89803試験では、bolus 5-FU (RPMIレジメン) に対するCPT-11の上乗せ効果 (IFL療法)が検討された。結果として両群の予後に差はなく、CPT-11の上乗せ効果は認められなかった。
一方、6ヵ月以内の治療関連死はIFL群で2.8%、5-FU/LV群では1.0%とIFL群で有意に高く (P=0.008)、IFL療法はstage III結腸癌の術後補助化学療法として用いるべきではないとの結論に至った26)。
ヨーロッパでは、infusional 5-FU/LVに対するCPT-11の上乗せ効果を検討するため、2つの大規模無作為化比較第III相試験が行われた。
・PETACC-3試験
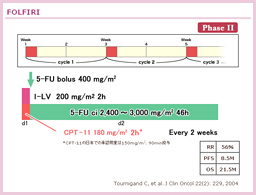
Stage IIハイリスク/ III結腸癌を対象に、LV5FU2(一部AIOレジメンを含む)に対するCPT-11の上乗せ効果を検討した試験である27)。追跡期間中央値は66.3ヵ月で、主要評価項目である5年DFS (FOLFIRI vs. LV5FU2 = 56.7% vs. 54.3%, P=0.106) および5年OS (73.6% vs. 71.3%, P=0.094) の双方に有意差は認められなかった。
有害事象については、FOLFIRI群におけるGrade 3/ 4の消化管毒性および好中球減少の発生率が高かった。
・ACCORD02試験
対象症例をstage IIIハイリスクに限定し、FOLFIRIとLV5FU2の比較・検討が行われたが、PETACC-3試験と同様に、stage IIIハイリスク症例においても、infusional 5-FUに対するCPT-11の有意な上乗せ効果は得られなかった28)。
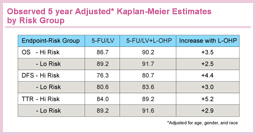
術後補助療法においてCPT-11の上乗せ効果が認められなかったのと対照的に、stage IIIの症例に対してL-OHPはLV5FU2、bolus 5-FU (RPMIレジメン)、Capecitabineのいずれの標準治療に関しても上乗せ効果が証明された。また、NSABP C-05、C-06、C-07、C-08の4つの臨床試験データを用いて、5-FU/LVに対するL-OHPの上乗せ効果をOS、DFS、TTR (time to recurrence) を評価項目として統合解析した結果、全例およびstage IIIでは、すべての評価項目で有意なL-OHPの併用効果が認められた54)。Stage IIにおいても、すべての評価項目でハザード比が1を下回り、L-OHP併用による予後の改善傾向が示された。また、Kaplan-Meier法による5年生存率推定値は、L-OHP併用により2.4〜5.2%の上乗せ効果がみられ、特にハイリスクstage II (穿孔、T4、検索リンパ節数12個以下と定義) では3.5%の上乗せ効果が認められた。
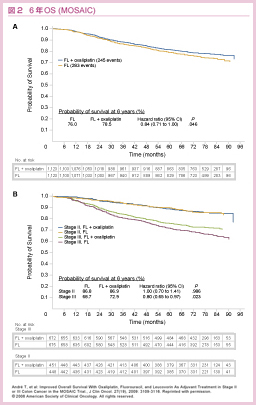
Stage II / III結腸癌を対象に、infusional 5-FU (LV5FU2) へのL-OHPの上乗せ効果を検証した試験がMOSAIC試験である29, 30)。2009年に報告された長期追跡結果では、全体の5年DFSはFOLFOX群で73.3%、LV5FU2群では67.4%であり、FOLFOX群で有意に良好であった (追跡期間中央値73.5, 73.4ヵ月, HR=0.80, 95% CI: 0.68-0.93, P=0.003) 30)。
Stage別の5年DFSは、stage IIIではFOLFOX群で66.4%、LV5FU2群では58.9% (HR=0.78, 95% CI: 0.65-0.93, P=0.005) であり、FOLFOX群のほうが有意に良好であった。一方、stage IIでは有意差は認められなかったが (各々83.7%, 79.9%, HR=0.84, 95%CI: 0.62-1.14, P=0.258)、stage IIハイリスク症例に限定するとFOLFOX群で良好な傾向にあった (各々82.3%, 74.6%, HR=0.72, 95% CI: 0.50-1.02)。
6年OSについては、stage IIでは両群間に差を認めなかったが、stage IIIではFOLFOX群が72.9%、LV5FU2群では68.7%とFOLFOX群が有意に良好であり (追跡期間中央値 81.9ヵ月, HR=0.80, 95% CI: 0.65-0.97, P=0.023)、結果として全体でも有意差が認められた (P=0.046)(図2)。
以上より、stage IIIにおいては生存に対するL-OHPの上乗せ効果が認められ、またstage IIにおいてもハイリスク症例に限っては有効かもしれないと結論づけられた 30)。
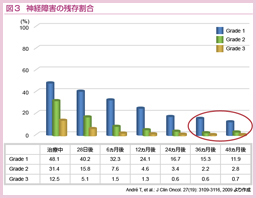
なお、L-OHPの有害事象としては神経毒性が挙げられるが、本試験では、化学療法終了4年後も15%超の症例にGrade 1-3の末梢神経障害が残存していることも明らかになった(図3)。
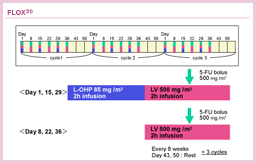
NSABP C-07試験は、MOSAIC試験と同じくstage II/ III結腸癌を対象に、FLOXおよびbolus 5-FU (RPMIレジメン) を比較・検討した試験である31-33)。FLOXはRPMIレジメンにL-OHPを隔週で追加する投与法でpump-freeが特徴であり、主に米国で広く用いられている。
ASCO2008で報告された長期追跡結果 (追跡期間中央値 67ヵ月) では、全体の5年DFSはFLOX群で69.4%、5-FU/LV群では64.2%と5.2%の上乗せが認められ、RPMIレジメンに対してもL-OHP併用の有用性が示された32)。同試験におけるL-OHPの末梢神経障害については、患者の自己評価に基づいた詳細な報告がなされている33)。
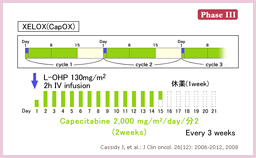
CapecitabineとL-OHPの併用療法を検討したNO16968 /XELOXA試験 34, 35)では、XELOX群において、bolus 5-FU群 (MayoまたはRPMIレジメン) に比して5年DFSの6.3%の上乗せが認められた (追跡期間中央値 57ヵ月, HR=0.80, 95% CI: 0.69-0.93, P=0.0045) 35)。本邦では、2011年11月に結腸癌術後補助化学療法としてのXELOX療法が保険適応となった。
GI cancer-net
消化器癌治療の広場