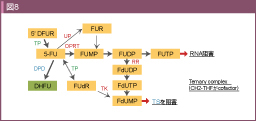
5-FUは腫瘍内に取り込まれ、その多くが分解酵素であるジヒドロピリミジンデヒドロゲナーゼ (Dihydropyrimidine dehydrogenase: DPD) により分解され不活化される。分解を受けなかった5-FUは、細胞内でオロテートホスホリボシル トランスフェラーゼ (Orotate phosphoribosyl trasnferase: OPRT) などによりリン酸化を受け、活性代謝体に変化し、殺細胞効果を発揮する。活性代謝体の5-fluoro-deoxyuridine monophosphate (FdUMP) は、還元型葉酸補酵素の5,10-methylene tetrahydrofolateの存在下にDNA de novo系酵素のチミジレートシンターゼ (Thymidylate synthase: TS) と三元共有結合複合体 (Ternary complex) を形成し、TSの酵素活性を阻害する。これにより、DNAのde novo合成系は抑制され、DNA障害が時間依存性に惹起される (図8)。
また、Capecitabineは、腫瘍内のチミジンホスホリラーゼ (Thymidine phospholylase: TP) により5-FUに変換される。
これまで5-FU系薬剤の効果予測因子として、上述の5-FU代謝に関連した酵素の遺伝子発現と予後および治療効果との関連についての検討が多数行われている。後ろ向きの研究より、5-FUの標的因子であるTS発現の低い群や5-FUの分解酵素であるDPD発現の低い群で予後が良好であること、また奏効率が高いことが報告されているものの65, 66)、関連を否定する報告も多く、現時点ではcontroversialである。
遺伝子多型と5-FUの有害事象との関連について、5-FU単剤療法 (Leucovorinの併用含む) を行った683名の前向き観察研究において、TS遺伝子 (TYMS) 5`非翻訳領域のタンデムリピート数の多型のうち2R/2Rを有する患者ではGrade 3以上の下痢の発生頻度が高かったと報告されたが67)、別の研究ではその相関は否定されている68)。
また、逐次治療 (LV5FU2→FOLFOX→FOLFIRI) と併用療法 (FOLFOX→FOLFIRI)を比較したFFCD2000-2005試験の410例のうち346例 (84%) を対象とした付随研究において、TSの遺伝子型が2R/2Rおよび2R/3Rの症例では、逐次治療群に比較して併用療法群で有意にPFSが延長していたが、3R/3Rの症例ではPFSの有意な延長は認めなかった69)。このことから、TS遺伝子型は効果予測因子になりうると期待され、FOCUS試験の検体を用いてvalidationが試みられたが、TS遺伝子型と治療効果との相関は認めなかった70)。
5-FUをはじめとする細胞毒性抗癌剤の代謝や抗腫瘍効果の機序には、非常に多くの因子が複雑に関与していると考えられ、単一の因子が効果予測バイオマーカーとして選定される可能性は少ないのかもしれない。
Oxaliplatin (L-OHP) はプラチナ系薬剤のひとつであり、GSHと結合することにより解毒されるが、その反応を触媒する酵素がglutathione S-transferase-π (GST-π)である。GST-π遺伝子 (GSTP1) の遺伝子多型がFOLFOX療法の奏効率や末梢神経障害の頻度と相関するという報告もあるが71)、その関係を否定する報告もあり、controversialである72)。
プラチナ系薬剤は、DNAのアルキル化により架橋を形成して抗腫瘍効果を示すが、このDNA修復機構であるnucleotide excision repair (NER) に関与する因子にexcision repair cross-complementing 1 (ERCC1) やERCC2 (XPD) がある。FOLFOX療法を施行した大腸癌を対象にした後ろ向きの研究において、ERCC1高発現例で予後が悪い傾向にあることや73)、ERCC1やERCC2 (XPD) の遺伝子多型が抗腫瘍効果や予後と相関があること74)など、さまざまな報告があるが、確立されたバイオマーカーはない。
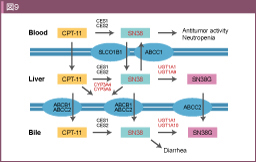
Irinotecan (CPT-11) はプロドラッグであり、主に肝臓のカルボキシエステラーゼ (Carboxylesterase: CES) により加水分解され、活性型のSN-38に変換される。SN-38は癌細胞でDNA複製に重要な働きをするtopoisomerase-1 (topo-1) を阻害することで抗腫瘍効果を発揮する。一方で、SN-38は肝臓内でUDP-グルクロン酸転位酵素 (UDP-glucuronyltransferase: UGP) により抱合代謝を受け、水溶性のSN38-Gとして胆汁中から排泄される (図9)。
・効果予測因子 topo-1?
Topo-1は大腸癌の43-51%で高発現しており75, 76)、前臨床ではtopo-1活性とCPT-11の感受性に正の相関がみられる77)。
一次治療としての5-FU単独療法と、5-FU + CPT-11 / L-OHP併用療法とを比較したFOCUS試験に登録された1,628例のうち1,313例 (81%) を用いたバイオマーカー研究において、topo-1低発現群ではCPT-11またはL-OHPを5-FU単独治療に追加することで有意なPFSの延長はみられなかったが、中等度/高発現群ではいずれかの薬剤の追加により有意な延長効果を認めた78)。
本報告はtopo-1発現量がCPT-11の効果予測因子となりうる可能性を示唆しており、前臨床の結果と一致している点で興味深いが、なぜL-OHP併用の場合にも同様の傾向がみられるのかは不明である。
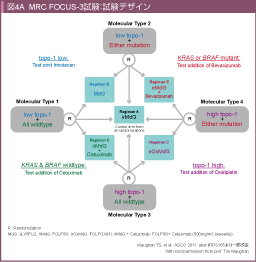
この結果を受けて、現在UKにてtopo-1の発現量とKRAS / BRAF 変異の有無から患者を4群に分け、各群それぞれ3群ずつに無作為割付を行うbiomarker-orientedのRCT (MRC FOCUS-3試験) が行われている93) (図4A)。
・効果予測因子 DPD?
CAIRO試験に登録された803例のうち556例 (69%) を対象に行われたバイオマーカー研究66)では、DPDのCPT-11の効果予測因子としての可能性が示唆された。CAIRO試験は切除不能大腸癌初回治療例を対象に、Capecitabine (一次) → CPT-11 (二次) 逐次治療 vs. Capecitabine + CPT-11併用療法を比較・検討した第III相試験である79)。
その結果、DPD発現量が低い群では、逐次治療群と比較して併用療法群で一次治療のPFSが有意に延長していたが、DPD発現量が高い群では差を認めなかった66)。このことはDPD発現量がCPT-11の効果予測因子となる可能性を示唆しているが、その機序は全く不明であり、前向きな追試が必要である。
・有害事象の予測因子 UGT1A1遺伝子多型 ![]()
UGTのうち、UGT1A1遺伝子多型とCPT-11の有害事象との関連が明らかになっている。酵素活性の低いアレルのうち、UGT1A1*28は白人で約30-40%、アジア人で約15%に認められ80)、UGT1A1*6は白人ではまれであるが、アジア人では約30%に認められる81)。この2つの遺伝子多型の測定は本邦で保険適応となっている。
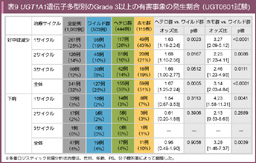
UGT1A1*6もしくは*28のホモもしくはダブルへテロを有する患者 (ホモ群) は日本人のうち約10%を占めている (表8)。CPT-11を含む治療を行った1,062例の報告によればワイルド群、ヘテロ群、ホモ群での重篤な好中球減少が生じる確率は25%, 35% (オッズ比1.67), 51% (オッズ比3.14) であり、重篤な下痢が生じる確率は4%, 4% (オッズ比0.96), 10% (オッズ比3.28) であり、特にホモ群ではCPT-11投与による重篤な好中球減少や下痢が生じる頻度が高い (表9)124)。
またメタ解析において、CPT-11投与量が125mg/m2よりも多い場合、UGT1A1*1/*28を有するアジア人ではUGT1A1*1/*1を有する患者よりもGrade 3以上の下痢の発生頻度が高いことも指摘されている83)。
UGT1A1遺伝子多型別のFOLFIRI療法におけるCPT-11の用量決定試験がいくつか報告されている。スペインからの報告では*28/*28群においてCPT-11の投与量150mg/m2とした5例中2例で用量制限毒性が生じたためCPT-11の推奨投与量は130mg/m2と決定された。また、韓国からの報告では*6と*28のホモ群4例に対しCPT-11 150mg/m2のFOLFIRI療法を行ったが用量制限毒性を認めず、150mg/m2を推奨用量としている。現在、本邦でもホモ群に対する至適投与量決定試験が行われている。
GI cancer-net
消化器癌治療の広場