がん胎児性抗原 (Carcinoembryonic antigen: CEA) は、上皮細胞の細胞間接着や分化にかかわるタンパクである。消化器癌における腫瘍マーカーの臨床使用に関する欧米のrecommendationでは、切除不能進行再発大腸癌に対して化学療法を行う際は、治療効果の指標として、1〜3ヵ月ごとに血清CEA値を測定することが推奨されている24, 25)。
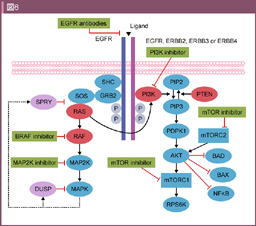
上皮成長因子受容体 (Epidermal growth factor receptor: EGFR) はHER (ErbB) familyのチロシンキナーゼ受容体であり、170kDaの膜貫通型糖タンパク受容体である。正常組織では細胞分化や増殖、維持に重要な役割を果たしている一方で、癌組織においても増殖や浸潤、転移に強く関与し、大腸癌の60-80%でEGFRの高発現を認める26)。
EGF, TGF-αなどのリガンドが結合すると、EGFRあるいは他のHER family受容体と二量体を形成し、細胞内チロシンキナーゼドメインの自己リン酸化、さらに下流へのシグナル伝達経路が活性化される (図6)。EGFR下流の伝達経路は多数存在するが27)、主にRas-Raf-MAPK経路およびPI3K-Akt経路が注目されている。
抗EGFR抗体薬であるCetuximabとPanitumumabは、一次治療、二次治療以降での細胞毒性抗癌剤との併用ならびに単独投与での有効性が多数の大規模臨床試験により示されている。しかし、皮膚障害などの有害事象やコストの観点から、利益の得られる患者集団を絞り込むことが重要であると考えられ、効果予測バイオマーカーの探索が行われてきた。
Cetuximabは、前臨床段階でEGFR発現陽性細胞株に対し抗腫瘍効果が認められたことから、免疫染色によるEGFR発現陽性症例に対象を限定して臨床開発が進められた。しかし、抗EGFR抗体薬使用例の後解析にて、EGFR発現のない例でも効果が認められ、免疫染色法でのEGFR発現程度と抗EGFR抗体薬の効果は相関しないことが示された28, 29)。その要因として、免疫染色の方法や抗体の種類、原発巣と転移巣でEGFR発現が異なることなどが挙げられる。Panitumumabのpivotal studyであるPRIME試験および20050181試験の後解析でも、EGFR発現の程度に関係なく、Panitumumabの効果が示された96, 97)。現在、免疫染色法によるEGFR発現の有無は、抗EGFR抗体薬の効果予測因子とは考えられていない。
一方、EGFR遺伝子コピー数 (gene copy number:GCN) 増加も大腸癌の12〜17%に認められ、抗EGFR抗体薬の効果予測因子として検討されている。抗EGFR抗体薬を含む化学療法を行った群の後解析にて、EGFR-GCN高値群で奏効率やPFSが良好であったとの報告が散見される41, 44)。今後は、大規模比較試験のサンプルを用いた検証とともに、FISHなどEGFR-GCNの測定・判定方法の標準化が課題となっている。
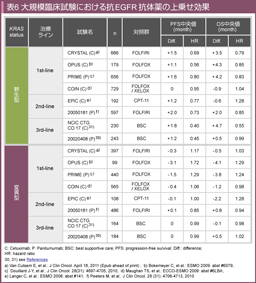
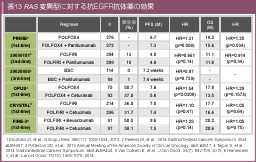
KRASは約21kDaの低分子GTP結合タンパクであり、EGFRからの増殖シグナルを下流に伝達する役割を持つ。KRAS 遺伝子変異は大腸癌の45-50%に認められ、そのうち約90%がcodon 12 (約70%)、codon 13 (約20%) に認められる34)。KRAS 変異の存在によりRasに内在するGTPase活性が低下し、GTPが結合した活性型に留まることで、下流への増殖シグナルが持続すると考えられている33)。多数の大規模RCTの後解析から、KRAS 遺伝子exon 2 (codon 12, 13) に変異のない野生型の患者群ではCetuximabおよびPanitumumabによる治療成績の上乗せが認められた一方、変異型では抗EGFR抗体薬による治療成績の上乗せが認められなかった30-32) (表6)。結果、米国食品医薬品局 (FDA)、欧州医薬品庁 (EMA) に次いで本邦でも2010年以降、抗EGFR抗体薬の投与対象をKRAS 遺伝子野生型症例に限定された。
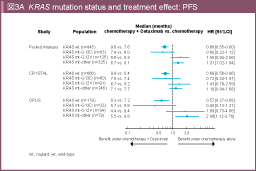
KRAS 変異のうちKRAS codon 13のグリシンからアスパラギン酸への変異 (G13D) を有する大腸癌はKRAS codon 12変異とbiologyが異なるという報告も散見される。本邦からの大規模な観察研究 (5,887例) では、G13D変異を有する大腸癌は全体の7.3%であり、女性、右側結腸で頻度が高い、年齢と頻度との相関が認められないなど、KRAS codon 12 変異型症例とは臨床病理学的特徴が異なっていることが報告された98)。De Roockらは、RCTに登録された症例を含む579例の後ろ向き解析において、KRAS G13D変異型大腸癌32例に対しては、Cetuximabを含む治療を行うことで無増悪生存期間 (Progression-free survival: PFS) や全生存期間 (Overall survival: OS) が延長する傾向がみられたと報告した35)。また、Tejparらは、切除不能大腸癌初回治療例を対象としたFOLFIRI ± Cetuximab (CRYSTAL試験) およびFOLFOX ± Cetuximab (OPUS試験) の2つのRCTに登録された症例を対象に、KRAS 野生型、G13D変異型、G12V変異型、その他のKRAS 変異型におけるPFSおよびOSの解析結果を報告した86)。
結果、Cetuximab非併用群のPFSおよびOSは、KRAS G13D変異型ではその他のKRAS 変異型と比較し、ハザード比が1.54、1.39と予後不良であった。また、Cetuximab併用群のPFSは、KRAS G13D変異型ではCetuximab非併用群と比較し、ハザード比が0.60 (95%CI: 0.32-1.12) であり、KRAS 野生型と同程度の上乗せ効果が示唆された (図3A)。一方、Panitumumabを用いた3つの第III相試験 (PRIME試験、20050181試験、20020408試験) におけるKRAS codon 12, 13変異と予後・治療効果に関する検討も報告されている。結果、Panitumumab非併用群のPFSおよびOSの検討において、KRAS G13D変異と予後との相関は明らかにはならなかった。また、Panitumumabの効果に関する検討では、PRIME試験ではKRAS G12V変異においてPanitumumab + FOLFOX4群のOSがFOLFOX4群に比べて良好であったが (p=0.0369)、KRAS G13D変異においてはFOLFOX4群が良好であった (p=0.0018) 99)。以上より、KRAS G13D変異に対する抗EGFR抗体薬の効果については、大規模比較試験の後解析でも共通した結果が得られていない。最近、治療抵抗性のKRAS G13D変異例12例を対象にCetuximab単独療法の第II相試験の結果が報告されたが、6ヵ月時点での病勢コントロール率は0%であった113)。現時点ではKRAS G13D変異例を含めKRAS exon 2変異例には抗EGFR抗体薬投与により利益が得られない可能性が高く、抗EGFR抗体薬の投与は推奨されないと考えられる。
その他のKRAS 変異として、codon 61変異 (約2%)、codon 146変異 (約2%) が知られている。これらの変異例がcodon 12, 13変異例と同様の臨床病理学的特徴を有するか十分には明らかになっていない。Imamuraらは、codon 61, 146変異例は KRAS 野生型と比較して盲腸に多い、CIMP-lowが多い、PIK3CA 変異例が多い、などexon 2 (codon 12, 13)変異例とほぼ同様の特徴を持つと報告している114)。KRAS minor変異が抗EGFR抗体薬の効果予測因子となるかについては、抗EGFR抗体療法が行われた化学療法抵抗性大腸癌1,022例 (うちDNA解析可能症例747例) の後解析がEuropean consortiumから報告されており、Codon 61変異がみられた13例では抗EGFR抗体療法での奏効例を認めなかったが、codon 146変異がみられた11例のうち2例 (18.2%) で奏効が認められた。また、codon 146変異例のうち2例には別部位のKRAS 変異が認められた36)。以上から、codon 61変異例には抗EGFR抗体薬が無効であり、codon 146変異は抗EGFR抗体薬の効果予測因子とならない可能性が考えられた。しかし、極めて少数例の検討であり、変異の部位によって抗EGFR抗体薬の効果が異なるかについては今後症例を重ねて慎重に検討する必要がある。
NRAS 変異は大腸癌の約3-5%に認められ、変異部位としてはexon 2 (codon 12, 13)、codon 61変異が多く、原則KRAS 変異と相互排他的である。また、原発部位としては、直腸からS状結腸でやや頻度が高いことが知られている。MRC COIN試験の後解析では、NRAS 変異例はKRAS、BRAF、NRAS 野生型例と比較して予後不良であると報告されている。抗EGFR抗体薬の効果については、European consortiumからの報告では奏効率は7.7% (1/13例)、PFS中央値14週、OS中央値38週と、KRAS、BRAF、NRAS 野生型と比較していずれも不良であった。また、Panitumumab単剤療法とBSCを比較した20020408試験に登録された症例と、BSC群でPDとなった後、クロスオーバーでPanitumumabを使用する第II相試験 (20020194試験) に登録された症例のうち288例 (全体の約70%が対象、257例にPanitumumabを投与) を対象に9遺伝子41 exonの変異の有無とPanitumumabの効果を比較した報告87)では、NRAS 変異のない126例の奏効率は17.5%であったのに対し、NRAS 変異を有する9例では0%であった。PFSに関しても、NRAS 野生型ではPanitumumab vs. BSCのハザード比が0.39 (95% CI: 0.27-0.56) であるのに対し、NRAS 変異型では1.94 (95% CI: 0.44-8.44) であった。さらに後述するPRIME試験のexpanded RAS 解析においてもNRAS (exon 2, exon3) 変異型では、FOLFOX4 + Panitumumab vs. FOLFOX4のハザード比がPFS 1.30 (95% CI: 0.63-2.69)、OS 1.17 (95% CI: 0.56-2.43) と報告されており、NRAS 変異型大腸癌への抗EGFR抗体薬のメリットは乏しいと考えられる。
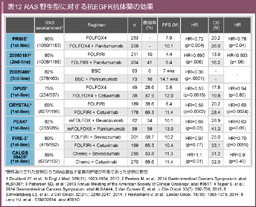
2013年、PRIME試験においてKRAS exon 3 (codon 59, 61), exon 4 (codon 117, 146) 変異とNRAS 変異を合わせたnew RAS 変異型ではFOLFOX4 + Panitumumab vs. FOLFOX4のPFSハザード比 1.28とKRAS exon 2変異型と同様にPanitumumabの上乗せ効果が認められないことが明らかとなった。RAS 野生型ではPFS中央値10.1 vs 7.9か月 (HR=0.72, p=0.004) とKRAS exon2野生型でのPanitumumabによる上乗せ効果 (HR=0.80, p=0.02) よりも効果が大きいことが明らかとなった。本報告以降、Panitumumabに関する2nd-line治療、3rd-line治療での試験やCetuximabに関する臨床試験においても、RAS 変異型には抗EGFR抗体薬の効果が乏しいことが再現性をもって示された (表12, 13) 。欧州では既に抗EGFR抗体薬の適応がRAS 野生型へと限定されており、本邦においても2015年4月にRAS 遺伝子検査が保険償還され、Cetuximab/Panitumumabの薬剤添付文書も改訂された。
BRAFはRas-Raf-MAPK経路を構成するセリンスレオニンキナーゼである。BRAF 変異は大腸癌の5-10%に認められ、その90%以上が、codon 600のバリンからグルタミン酸への変異 (V600E) である。BRAF 変異を認める大腸癌ではほとんど全てKRAS 変異を認めず、相互排他の関係にある。BRAF 変異型大腸癌は野生型と比較して、右側結腸原発、低分化型、深達度T4、腹膜播種が多い、等の臨床病理学的特徴を持つことが知られている117、118)。また、散発性MSI-H大腸癌においては約40%と高率にBRAF 変異を認める。
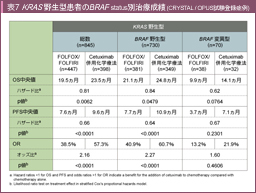
Salvage lineで抗EGFR抗体薬を投与された113例を対象とした後ろ向きの解析において、KRAS野生型でかつBRAF 変異を有する11例では奏効例を認めなかった。またBRAF 変異症例ではBRAF 野生型と比較してPFSが有意に短かった37)ことから、BRAF 遺伝子変異は抗EGFR抗体薬の無効因子である可能性が示唆された。しかし、CRYSTAL試験とOPUS試験を統合した後ろ向き解析では、BRAF 変異型大腸癌はBRAF 野生型大腸癌と比較して極めて予後不良であった。しかし、PFS、OSの中央値はCetuximab併用群でそれぞれ7.1ヵ月、14.1ヵ月、非併用群で3.7ヵ月、9.9ヵ月、ハザード比は0.62、0.67と、BRAF 変異におけるCetuximabによる上乗せ効果が示唆される結果であった (表7) 38)。同様に、PRIME試験や20050181試験119)のBRAF 解析においても、PFS、OSのハザード比は1.0未満であり、抗EGFR抗体薬による予後延長効果が示唆されている。一方、COIN試験での後ろ向き解析では、BRAF 変異の患者群におけるOSの中央値はCetuximab併用群7.2ヵ月、非併用群10.0ヵ月と、逆にCetuximab併用群で不良であった100)。同様に二次治療においてCPT-11療法とCPT-11 + Panitumumab併用療法を比較したPICCOLO試験でも、BRAF 変異群においてはPanitumumab併用群の方がPFS、OSともに不良な傾向にあった101)。
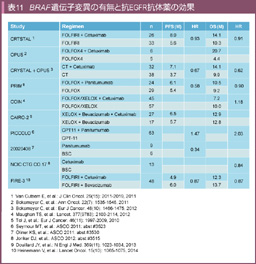
以上、前向き比較試験の後ろ向き解析からは、BRAF 変異が切除不能大腸癌における強い予後不良因子であることはコンセンサスが得られているが、BRAF 変異大腸癌に対して抗EGFR抗体薬が有効であるかは、一定の見解が得られていない。少なくとも著効、あるいは全く無効である可能性は低いと考えられ、現状BRAF 遺伝子変異の有無を確認せずに抗EGFR抗体薬投与が行われている(表11)。
PI3KはPIP2をPIP3にリン酸化する脂質キナーゼであり、触媒サブユニットであるp110と制御サブユニットp85のヘテロ二量体である。PIP3は下流のPDK1やAktを介し増殖シグナルとして伝達される。大腸癌では、PIK3CA 遺伝子がコードするクラスIA PIK3Kのαサブタイプ (p110α) が最も重要な役割を果たす。PIK3CA変異は約15%の大腸癌に認められ、ヘリカルドメインであるexon 9、キナーゼドメインであるexon 20の変異が多いとされる。PIK3CA 変異大腸癌は、KRAS 変異を有する例で頻度が高いとされ、予後不良因子との報告がある一方、予後とは相関しないという報告もある。抗EGFR抗体薬の効果予測因子となるかは、抗EGFR抗体薬を含む治療を行ったKRAS 野生型大腸癌患者の解析にて、PIK3CA変異例は奏効率、PFS、OSが不良な傾向にあったという報告39) や、exon 20の変異のみ治療成績が不良な傾向にあったという報告36)、PIK3CA 変異の有無は奏効率と相関がないという報告40) などがある。NCIC CTG CO.17試験の後ろ向き解析では、KRAS 野生型かつPIK3CA 変異型の26例において、Cetuximab + BSC療法はBSCと比較して奏効率 (20% vs. 12%)、OS (9.9ヵ月 vs. 3.6ヵ月) とも良好であり120)、同様の傾向が20020408試験の後解析でも認められている121)。以上から、PIK3CA 変異の有無が抗EGFR抗体薬の効果予測因子となるかについては一定の見解が得られていないものの、PIK3CA 変異例に対しても抗EGFR抗体薬は臨床的効果が認められる可能性がある。一方、FIRE-3試験の追加解析ではPIK3CA 変異例は38例 (7.3%) に認められ、奏効率 (47.4% vs. 57.9%)、PFS (7.8ヵ月 vs. 13.3ヵ月) ともにFOLFIRI + Bevacizumab群が良好な傾向であった。本データはRAS 変異が9例含まれているため解釈に注意が必要であるが、RAS 野生型における初回治療での抗EGFR抗体薬 vs. Bevacizumabのどちらを選択するかという観点では、PIK3CA 変異も抗EGFR抗体薬の効果予測因子として有用であることが示唆された。
PTENはPI3Kと逆の反応を触媒する酵素であり、PTEN 遺伝子は癌抑制遺伝子として働く。大腸癌におけるPTENの機能低下は、PTENの遺伝子変異 (大腸癌の約5%)、LOH、プロモーターメチル化等によって生じ、免疫染色法 (IHC) によるPTEN発現の低下は大腸癌の約20-40%に認める。抗EGFR抗体薬単剤療法を施行した患者の治療成績とPTEN発現との相関を検討した統合解析では、PTEN発現陰性例は28.4%であり、KRAS 野生型においてPTEN発現陽性例と比較してPFS、OSが不良であった102)。一方、抗EGFR抗体薬のon/offを比較した試験の後解析を見てみると、NCIC CTG CO.17試験 (KRAS 野生型) におけるCetuximab群とbest supportive care (BSC) 群との比較では、PTEN発現陽性例 (72%) vs. 陰性例で奏効率 (21% vs. 15%)、OS (ハザード比0.66 vs. 0.63) と、PTEN発現の有無にかかわらずCetuximabの有効性が示唆された 120)。Panitumumab vs. BSCの比較試験である20020408試験の後解析 (KRAS 野生型) では、PTEN 変異なし vs. 変異あり (6%) で奏効率 (16% vs. 11%)、PFS (ハザード比0.36 vs. 0.11) と、PTEN 変異の有無にかかわらずPanitumumabの有効性が示唆された121)。少なくともPTEN発現なし、PTEN 変異ありの症例で抗EGFR抗体薬が絶対に効かないという知見は得られていない。PTEN発現の評価は免疫染色法で行われているが、報告によってPTEN発現陽性率に大きな差がみられる。今後はPTENの機能喪失について、評価方法の統一が必要である。
Amphiregulin (AREG)、Epiregulin (EREG) はEGFRのリガンドであり、リガンド依存性のEGFR経路活性化に重要な役割を果たしている。AREG、EREG発現が亢進している癌では、増殖がEGFR経路に依存しているため、抗EGFR抗体薬の効果が高いというモデルが提唱されている。Cetuximabを含む治療を受けた大腸癌220例の解析において、KRAS 野生型ではAREG、EREGの発現量が高い群でPFSおよびOSの有意な延長が認められたが、KRAS 変異型ではこの傾向はみられなかったとの報告がある43)。また、3つの臨床試験でCetuximab単剤療法を受けた144例を対象に、110個の候補遺伝子発現量とCetuximab単剤療法の効果の相関を検討した後ろ向き解析においても、AREG、EREGの発現量が高い群で奏効例が多かった88)。一次治療におけるXELOX + CetuximabとXELIRI + Cetuximabを比較した無作為化比較第II相試験 (AIO KRK-0104試験) の登録症例185例中99例を対象に行った解析結果が報告され、同様にAREG、EREGの発現量が高い群は低い群に比較して、奏効率およびPFS、OSが良好な傾向にあった89)。また、MRC COIN試験に登録された1,630例中952例 (57%) での後解析では、EREG高発現はKRAS 野生型症例においてCetuximabの効果が高いことが報告された104)。さらにPICCOLO試験においてAREG、EREGの発現量が高い (いずれかが第1三分位) 症例では、CPT-11 + Panitumumab群のPFSがCPT-11群と比較して有意に良好 (HR=0.38, p<0.001) である一方、発現量が低い群ではPanitumumabの上乗せ効果を認めなかった (HR=0.93, p=0.73) 122)。
以上から、腫瘍効果とAREG、EREGの発現量と抗EGFR抗体薬の治療効果の関連が示唆される。しかし、現時点では、AREG/EREG発現の測定・評価方法・高値群と低値群のカットオフ値が統一されておらず、AREG、EREGの臨床的な有用性は明確になっていない。
マウスヒトキメラ型IgG1抗体であるCetuximabは、抗腫瘍効果としてEGFR経路の阻害のほかに、抗体依存性細胞傷害 (Antibody-dependent cell cytotoxicity: ADCC) が関与している可能性が報告されている。ADCCは腫瘍に結合した抗体と、マクロファージならびに単球の表面に発現しているFcγレセプター (FCGR) が結合して活性化される。
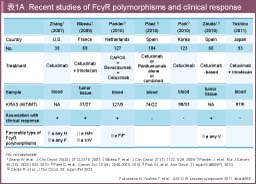
Cetuximabの臨床効果とFCGR 遺伝子多型との相関について、BibeauらはCetuximab + CPT-11療法を行った61例を対象に後ろ向きに解析を行った。結果、ADCC活性が高いと考えられるFCGR 2A-131HHもしくはFCGR 3A-158VV群は、131R/158F群と比較して奏効率およびPFSが良好であったと報告した (奏効率 = 27% vs. 8%, PFS = 5.5ヵ月 vs. 3.0ヵ月) 45)。一方、大腸癌初回治療例を対象としたCapeOx (XELOX) + Bevacizumab + CetuximabのRCT (CAIRO-2試験) のうちCetuximab併用群127例を対象とした研究においては、FCGR3A 158F群が158VV群よりPFSが良好であったと、Bibeauらと正反対の結果が報告されている46)。また、FCGR 遺伝子多型とCetuximabの効果とは相関しないという報告もある47, 48)。Cetuximabを含む化学療法が行われた症例のプール解析 (欧州15施設899例、本邦91例、米国133例) では、KRAS 野生型においてFCGR2A-131 HH群とnon-HH群との間にPFS (22週 vs. 22週)、OS (55.4週 vs. 53.4週) に差を認めず、FCGR3A-158 VV群とnon-VV群のPFS (16.4週 vs. 23週)、OS (50週 vs. 54週) にも有意差を認めなかった123)。FCGR 遺伝子多型は人種差が大きく、日本人ではFCGR3A-158VVは約4%と非常に少ない。Cetuximabの抗腫瘍効果にADCC活性が関与しているかどうか、さらにFCGR 遺伝子多型が効果予測因子になりうるかどうかさらなる検討が必要である (表1A)。
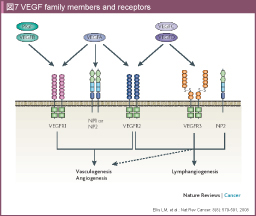
血管内皮細胞成長因子 (Vascular endothelial growth factor: VEGF) は脈管形成に関わる代表的な因子である。VEGFファミリーは、VEGF-A、VEGF-B、VEGF-C、VEGF-D、PlGF (Placental growth factor) の5つが知られている。VEGF-Aが血管新生に最も関与していることから、通常VEGFといえばVEGF-Aのことを指す。VEGFは腫瘍細胞などから分泌され、血管内皮細胞に発現する受容体と結合し効果を発揮する。VEGF受容体にはVEGFR-1 (FLT-1)、VEGFR-2 (FLK-1)、VEGFR-3 (FLT-4) があり、さらにキナーゼ活性を欠き、単独では作用しないがVEGFR-2の作用を増強する受容体としてneuropilin がある。VEGF-AはVEGFR-1、VEGFR-2、neuropilinと結合して腫瘍血管新生および腫瘍増殖に関与しているとされ、VEGFとVEGFR-2の結合が血管新生において最も重要であると考えられている (図7)。大腸癌においても、VEGFの発現が高いほど予後不良であるという報告が散見される49, 50)。
BevacizumabはVEGFに特異的なヒト化モノクローナルIgG1抗体薬であり、作用機序として (1) 血管内皮細胞に発現するVEGF経路を阻害して血管新生を阻害する、(2) 腫瘍細胞に直接作用し抗腫瘍効果をもたらす、(3) 腫瘍血管のnormalizationを起こし、併用抗癌剤のがんへの到達量が増加するなど、さまざまな機序が考えられている51, 52)。
Bevacizumabは、切除不能進行再発大腸癌に対する一次および二次治療での有効性が証明されている一方で53-55)、頻度は低いものの消化管穿孔や動脈血栓等の重篤な合併症が知られており56)、有害事象や治療効果を予測するバイオマーカーの探索は重要である。しかし、これまでに大腸癌を含むさまざまな癌腫においてBevacizumabのバイオマーカーの探索が行われているが、現時点では確立されていない。
一次治療において、IFL療法単独群に比較してBevacizumab併用群でOSが有意に改善することを示したAVF2107g試験55)の付随研究では、813 例中295例において腫瘍組織のKRAS、BRAF、p53変異の有無とBevacizumabの効果との相関について検討が行われたが、明らかな相関を認めなかった57)。
FOLFOX4 / XELOX療法にBevacizumabを併用することによりPFSが有意に延長することを示したNO16966試験53) の付随研究では、1,401例のうち247例の腫瘍組織を用いた解析を行い、CD31、VEGF-A、VEGFR-1、VEGFR-2、neuropilin、HER2、EGFRの7 つの発現量を免疫染色で評価した。その結果、VEGF-A 高発現群、CD31高発現群 (血管数と相関)、neuropilin低発現群、HER2 低発現群の各群においてBevacizumabの有効性が高い傾向にあった58)。Neuropilinは、切除不能進行再発胃癌を対象にCapecitabine + Cisplatin (XP) 療法とXP+Bevacizumab療法とを比較した第III相試験 (AVAGAST試験) 59) のバイオマーカー解析においても、neuropilin低発現群でBevacizumab併用によりOSが延長する傾向を認めており60)、効果予測バイオマーカーの候補として期待されている。
また、初回治療例を対象にCapecitabineとCapexitabine + Bevacizumab (CB)、Capecitabine + Bevacizumab + Mitomycin C (CBM) を比較した第III相試験 (MAX試験) のバイオマーカー解析では、471例中268例 (57%) の腫瘍組織におけるVEGF-A、VEGF-B、 VEGF-C、VEGF-D、VEGFR-1、VEGFR-2発現量 (免疫染色) と治療効果との相関が検討され、VEGF-D低発現群でBevacizumabの効果が高いことが報告された91)。
Bevacizumabは血管内皮細胞に作用することから、血液中のサイトカインや因子の治療前後の測定値がバイオマーカーになりうるかどうかが検討されている。
Kopetzらは、FOLFIRI + Bevacizumabの単アーム第II相試験において、治療開始前後およびPD (Progressive disease) 前後における血中サイトカイン濃度と治療効果の相関を検討し、治療前IL-8値がPFSと有意に相関したと報告している61)。さらに、増悪時にはPlGFやVEGF-Dの濃度が上昇していること、Bevacizumabを含む治療の前後に血液採取を行った別の集団でも同様の傾向が確認されたことより92)、Bevacizumabの耐性には標的分子であるVEGF-A以外の、PlGFやVEGF-Dなどの因子が関与している可能性があると考えられる。
The 2011 European Multidisciplinary Cancer Congress (EMCC) において、転移性進行癌にBevacizumabを投与した6つの第III相試験のバイオマーカー解析の結果が発表され、いくつかの癌腫で血漿中のVEGF-A (plasma VEGF-A) がBevacizumabの効果予測因子となる可能性が示された105)。可溶性で短いVEGF-Aのisoform (VEGF-A 110、121など) に感度が高い新しいELISAキットを用いて、AVF2107g試験 (大腸癌)、AVAiL試験 (非小細胞肺癌)、AVADO試験 (乳癌)、AVOREN試験 (腎癌)、AVAGAST試験 (胃癌)、AVITA試験 (膵癌) の6つの臨床試験の血液サンプルを用いて後ろ向きに解析を行ったところ、乳癌、膵癌、胃癌ではBevacizumabの生存への上乗せ効果はplasma VEGF-A高値群においてのみ示されることが報告された。しかし、大腸癌の試験であるAVF2107g試験の解析では、plasma VEGF-A高値群 (カットオフ値は中央値) は低値群に比較して予後不良ではあるものの、Bevacizumabの生存への上乗せ効果は高値群、低値群両方で認められた。臨床試験により結果が異なった理由としては、癌腫の違い、検体保存状況の違い等が考えられている。今後、さらに別の臨床試験での追加解析が行われる予定である。
末梢循環血液中の血管内皮細胞 (Circulating endothelial cell: CEC) や血管内皮前駆細胞 (Circulating endothelial progenitor: CEP) の数がバイオマーカーとなりうるかが注目されている。Bevacizumabを含むFOLFOX、FOLFIRI療法などを行った症例を後ろ向きに解析したところ、baseline CEC値がPFSと有意に相関したと報告された62, 63)。しかし、XELOX + BevacizumabへのCetuximabの上乗せを検証した第III相試験 (CAIRO-2試験) の付随研究では、755例のうち473例で検討が行われ、baseline CEC値や治療開始後のCEC値とPFS、OSとの相関は認めなかったと報告されている64)。
GI cancer-net
消化器癌治療の広場