術後補助化学療法の目的は再発リスクを減少し、予後を改善させることである。現在、外科手術の結果得られた組織から、病理学的バイオマーカーである深達度 (T因子) とリンパ節転移の有無 (N因子) をもとに、再発率や予後の異なる病期 (Stage) に分け、術後補助化学療法の適応を決定している。
海外ではstage IIIに対し、標準治療として術後FOLFOX療法が推奨されているが、stage II全体には術後補助化学療法は推奨されていない。しかし、stage IIのなかでも再発率が高い集団 (高リスク) では、術後補助化学療法により再発リスクが減少する傾向を認めており、術後補助化学療法を考慮すべきとされている。
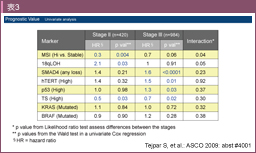
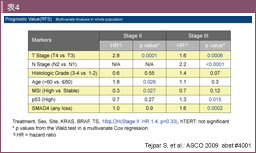
NCCNガイドラインでは、臨床病理学的な高リスク因子として、(1) 壁深達度T4、(2) 検索リンパ節数12個未満、(3) 組織型/低分化腺癌などが挙げられているが8) (表2)、レベルの高いエビデンスに基づいたものではない。現在、高リスクを選定しうる分子生物学的バイオマーカーの探索が行われている。

マイクロサテライト不安定性 (Microsatellite instability: MSI) は、ミスマッチ修復 (Mismatch Repair: MMR) 遺伝子の機能異常によるDNA複製エラーを反映する指標で、マイクロサテライトマーカーにおけるCA繰り返し配列の異常として検出できる。
MLH1、MSH2遺伝子など、ミスマッチ修復遺伝子の生殖細胞レベルでの異常は、大腸癌 (遺伝性非ポリポーシス大腸癌: Hereditary non-polyposis colorectal cancer; HNPCC) や子宮内膜癌などの発症リスクが高く、リンチ症候群 (Lynch syndrome) と呼ばれる。一方、孤発性大腸癌においても10-15%程度でMSIがみられる (sporadic MSI)9)。
MSIは大腸癌の発育・進展に広く関与し、メタアナリシスではMSIが高い (MSI-H) 大腸癌は、マイクロサテライト不安定性のない (Microsatellite stable: MSS) 大腸癌と比較して、右側結腸に多い、低分化型・粘液癌が多い、BRAF 変異陽性が多い、などの特徴がある106)。また、Stage II, IIIではMSI大腸癌はMSS大腸癌よりも再発率が低く、予後良好であると報告されている10)。
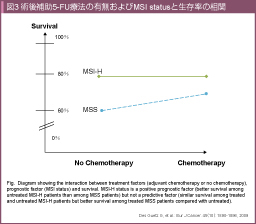
5-FUによる術後補助化学療法の効果を検討したメタアナリシスが行われ、MSI-H大腸癌には、術後補助5-FU療法による生存への上乗せが認められなかったと報告されている10) (図3)。一方、術後補助療法として5-FU/LV療法とFLOX療法を比較したNSABP-C07試験 (一部08試験の症例を含む) のサブグループ解析では、pMMR (MSS) とdMMR (MSI) でL-OHPの上乗せ効果に違いを認めなかった107) 。MOSAIC試験の追加解析では、dMMR例95例のサブグループ解析にてFOLFOX群、5FU/LV群の3年DFS、5年OSはそれぞれ88.6% vs. 78.4% (HR=0.48)、90.9% vs. 82.3% (HR=0.42) でありFOLFOX群で良好な傾向であった108)。
以上より、術後補助療法におけるMSI statusは予後良好因子であるものの、5-FUの治療効果予測因子となるかはcontroversialである。Stage IIIではL-OHPの上乗せ効果も示唆されており、本邦の臨床現場でもどのようにMSI statusを活用すべきか今後議論が必要である。
大腸癌の発生過程のなかで、ゲノム不安定性が重要な役割を果たすとされている13)。18番染色体長腕 (18q) の欠失あるいはヘテロ接合性の消失 (Loss of heterozygosity: LOH) は、大腸癌の70%以上で認められる。18qにはDCC遺伝子、smad4遺伝子など、腫瘍の増殖・転移を抑制する遺伝子がいくつか存在している。
Watanabeらは、2つの第III相試験 (INT0035試験、INT0089試験) に参加した高リスクstage II / III結腸癌460例の後ろ向き研究において、18q LOHを認める結腸癌は予後不良な傾向にあったと報告し14)、メタアナリシスでも同様の結果が報告されている15)。
一方、PETACC-3試験の付随研究では、18q LOHをstage II / III症例において各々63%、70%に認めた。Stage IIにおける単変量解析では予後不良因子であったが、多変量解析では有意差を認めず、stage IIIでは単変量、多変量解析ともに予後因子とはならなかった16)。
以上より、現時点ではstage II / III結腸癌における18q LOHのバイオマーカーとしての意義は明確になっていない。
・ECOG5202試験
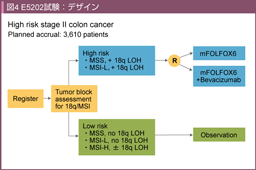
ECOG5202試験17)はstage II結腸癌を対象に、低リスク群を18q LOH陰性またはMSI-H、高リスク群を18q LOH陽性かつMSI-LまたはMSSとし、低リスク群には術後補助化学療法を行わず、高リスク群に対して術後補助化学療法としてmFOLFOX6もしくはmFOLFOX6 + Bevacizumabに割り付けるデザインであった。本試験はMSIと18q LOHのバイオマーカーとしての意義を検証する重要な試験と認識されていたが、他の大規模第III相試験において術後補助化学療法におけるBevacizumabの上乗せ効果が証明されなかったため、症例登録は中止された。
再発リスクを予測するバイオマーカーはひとつではないという観点から、複数の因子を組み合わせることで、より精度を高める研究が行われている。乳癌において実用化されているOncotype DXやMammaPrintのように、複数の遺伝子発現の組み合わせを用いた予後予測もそのひとつであり、現在、大腸癌に対しても開発が行われている。
・Oncotype DX Colon Cancer Assay ![]()
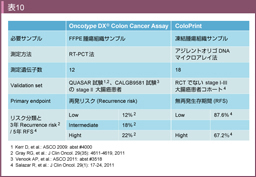
4つの大規模臨床試験 (NSABP C-01/C-02試験、Cleveland Clinic study、NSABP C-04試験、NSABP C-06試験) の手術単独群と、5-FUを含む術後補助化学療法群の手術組識検体から、RT-PCR法を用いて多重遺伝子解析を行い、再発および治療効果を予測する遺伝子を抽出した19)。
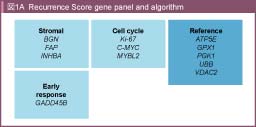
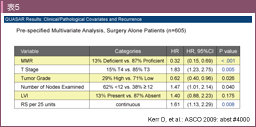
再発予測に関連すると考えられた遺伝子のなかから7遺伝子を選択し、コントロールとして5遺伝子を用い、合計12個の遺伝子の発現量から求められる再発スコア (Recurrence score: RS) を決定した (図1A)。QUASAR試験に登録されたstage II結腸癌患者1,436例を対象にRSのvalidationを試みた結果、RSは再発予測因子として有用であることが示された18) (表5)。また、T4患者はRS低値でも再発リスクが高く、逆にMMR deficient (MSI) の患者はRS値にかかわらず再発率が低かったことより、stage II患者全体の74%にあたるT3かつMMR proficient (MSS) の集団での再発リスク評価に特に有用であると考えられた84)。これら12個の遺伝子については、CALGB 9581試験 (結腸癌根治切除例を対象とした手術単独 vs. 抗EpCAM抗体補助療法) に登録されたstage II症例を対象に検証試験が行われ (解析対象690例)、T3かつMSS患者のRS高値、中間値、低値群の5年再発リスクはそれぞれ21%、16%、13%であり、その有用性が確認された85)。
また、NSABP-07試験に登録されたstage II/III結腸癌根治切除例を対象とした同遺伝子発現の検証試験では、5-FU/LV療法を受けた症例におけるRS高値、中間値、低値群の5年再発リスクは、stage IIIA/Bで38%、29%、21%、stage IIICで64%、51%、40%であり、stage II結腸癌と同様にstage III結腸癌においてもRSは再発リスクの予測に有用であることが確認された94)。これら12遺伝子からなる遺伝子発現キットはOncotype DX® Colon Cancer Assay (Genomic Health, Inc.) として商品化されている。本邦でも日本人stageIIおよびstageIII 結腸癌治癒切除例に対するOncotype DX Colon Cancer Assay再発スコアの妥当性に関する研究 (SUNRISE試験) が行われている109)。
・ColoPrint
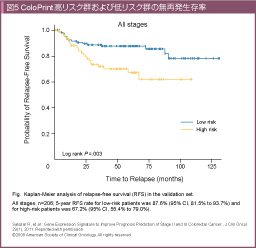
ColoPrintは、根治切除が行われた大腸癌188例のデータをもとに設定した18遺伝子を用いた、予後に関連する発現プロファイルである。別の206例で検証した結果、低リスク群の5年無病生存率 (Disease-free survival: DFS) が87.6%であったのに対し、高リスク群では67.2%であり、ハザード比は2.5 (95%CI: 1.33-4.73, p=0.005)であった (図5) 20)。
さらに、別のコホートを用いた検証試験がいくつか報告されている。Stage II結腸癌患者135例の検討が報告され、ColoPrintで低リスク群 (全体の73%) と分類された患者の5年DFSが94.9%であったのに対し、高リスク群と分類された患者 (27%) の5年DFSは80.5%と有意差が示された (p=0.009)。ColoPrintでの高リスク群はハザード比4.278 (95% CI: 1.35-13.50, p=0.013) と、従来のASCO recommendations*に基づいた高リスク群でのハザード比2.265 (95% CI: 0.68-7.53, p=0.183) を上回る有用性が示唆された21)。また、欧州5施設のstage II/IIIA 335例におけるT3/MSS 227例の解析においても、ColoPrint高リスク群での3年再発リスクのハザード比2.73 (95% CI: 1.3-5.8, p=0.01) と有意な予後因子となった95)。
現在、stage II 575例を含むstage II/III結腸癌患者1,200例を対象にColoPrintによるリスク階層化を検討する前向き観察研究 (PARSC試験) が欧米・アジアで進行中である22, 23)。
*T4, High grade, Perforation, and/or Less than 12 LN assessed

PI3K/Akt/mTOR経路のkey moleculeであるPI3K p110αをコードするPIK3CA 遺伝子は、大腸癌の約15%に変異が認められる。近年、PIK3CA 遺伝子変異が大腸癌におけるアスピリン療法の効果予測因子となるのではないかと注目されている。アメリカの前向きコホート研究から抽出した大腸癌患者964例を対象に、アスピリン常用と予後について解析したところ、PIK3CA 変異を有する大腸癌患者では5年OS (HR=0.54, p=0.01) がアスピリン常用群で良好であったが、PIK3CA 野生型では有意な差を認めなかった110)。また、術後補助療法としてRofecoxibとプラセボを比較したVICTOR試験での追加解析でも、長期低用量アスピリン内服群と非内服群での3年無再発生存率 (recurrence-free survival: RFS) がPIK3CA 変異型でハザード比0.11 (p=0.023)、PIK3CA 野生型で0.92 (p=0.71) であった111)。以上2つの報告からPIK3CA 変異型大腸癌では術後補助化学療法としてアスピリンが有効であり、PIK3CA 変異はアスピリン療法の効果予測因子となる可能性が示唆された。一方で、大腸癌患者999人の後ろ向き解析において、診断後アスピリン内服を開始した患者は、PIK3CA 野生型でOSが有意に良好であったが (HR=0.55, p<0.001)、PIK3CA 変異型では差を認めなかった (HR=0.73, p=0.44) という報告もある112)。
現時点では、PIK3CA 変異がアスピリン療法の効果予測因子となるか、補助化学療法においてアスピリンが有効かは明らかではなく、今後前向きランダム化比較試験での検証が必要と考えられる。
GI cancer-net
消化器癌治療の広場