治癒切除可能な肝転移症例に対する補助化学療法の目的は再発を抑え、OSを延長することである。肝切除後症例の再発率は50〜70%と高率であり、再発を予防するための術後補助化学療法が検討されてきた。
・全身化学療法
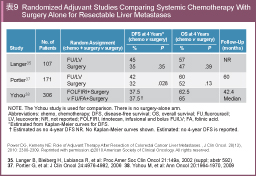
これまで術後補助全身化学療法に関して第III相試験が2つ報告されているが、いずれも症例集積が遅滞したために途中で中止されている。肝転移を含む転移巣切除後に経過観察のみを行う群と5-FU/LV療法による術後補助化学療法を比較したENG試験(EORTC / NCIC CTG / GIVIO試験) では計107例が登録され、4年DFSは各々35%、45% (HR=1.28, p=0.35)、4年OSは各々47%、57% (HR=1.30, p=0.39) と有意差を認めなかった40)。また、肝転移切除後に経過観察のみを行う群と5-FU/LV療法を行う群とを比較したFFCD 9002試験では計173例が登録された。5年DFSは多変量解析では有意に5-FU/LV群で良好であったが (5-FU/LV群33.5% vs. 経過観察群26.7%, HR=0.66, p=0.028)、5年OSでは有意差を認めなかった (同51.1% vs. 41.9%, HR=0.73, p=0.13) 41)。その後、上記2試験の統合解析が行われ (計278例)、単変量解析ではPFS (progression-free survival) 中央値27.9ヵ月 vs. 18.8ヵ月 (HR=1.32, p=0.058)、OS中央値62.2ヵ月 vs. 47.3ヵ月 (HR=1.32, p=0.095) であり、ともに化学療法 (5-FU/LV) 群で良好な傾向がみられたものの有意差は認めなかった。しかし、PSや腫瘍径、転移個数などの背景因子を含めた多変量解析ではPFS、OSともに化学療法群が有意に良好であった (PFS: HR=1.39, p=0.026, OS: HR=1.39, p=0.046) 42)。
さらに、いくつかの後ろ向き研究でも、術後補助化学療法を施行した群が施行しなかった群に比較してOSが良好であったと報告されている34,35)。Ychouらは肝転移切除術後補助化学療法として5-FU/LV療法を行う群とFOLFIRI療法を行う群を比較する第III相試験 (CPT-GMA-301試験) を行ったが、DFSに差を認めず、5-FU/LVに対するIrinotecan (CPT-11) の上乗せ効果は示せなかった43)。
以上、肝転移根治切除例に対する術後補助化学療法の有効性を示唆する報告はあるものの明確なエビデンスはなく、研究者によって解釈が定まっていない。しかし、stage IIIに対する術後補助化学療法の有効性が確立されている現在、より再発リスクが高い肝転移切除例に対し、術後補助化学療法を実地臨床で行うことは許容されると考える。本邦では、日本臨床腫瘍研究グループ (Japan Clinical Oncology Group:JCOG) にて肝転移根治切除例を対象に無治療経過観察 (手術単独) を標準治療としてFOLFOX療法の有効性を検証する第III相試験 (JCOG0603試験) が進行中である44)。
・肝動注療法 (HAI:hepatic arterial infusion)
肝転移切除後は残肝再発が約半数に起こるため、特に残肝再発の抑制がOS延長に結びつくと考えられ、補助化学療法としての肝動注療法が試みられてきた。
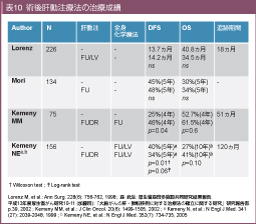
Kemeny MMらは75例と少数例ではあるが、術後経過観察する群とFloxuridine (FUDR) による肝動注+FUによる全身術後補助化学療法を行う群との無作為化比較試験を行い、化学療法群でDFSが有意に延長し (4年DFS: 25% vs. 46%, p=0.04)、OSも良好な傾向 (4年OS: 52.7% vs. 61.5%, p=0.06) であったと報告した45)。一方、ドイツのグループは術後無治療群と5-FU/LVによる肝動注補助化学療法群との比較試験を行い、DFS、OSに有意差を認めなかったと報告している46)。またMemorial Sloan-Kettering Cancer Center単施設で行われた全身5-FU/LV化学療法 vs. 全身5-FU/LV+肝動注FUDR療法の無作為化比較試験では、肝動注併用群でDFSが有意に良好であり、10年OSも良好な傾向にあった47,48)。国内の報告では、森らが術後5-FU肝動注を行う群と無治療経過観察群の無作為化比較試験を報告したが、5年のDFSおよびOSでは差を認めなかった49)。
NSABPでは、NCCTGとの共同で術後XELOX (Capeox)+肝動注FUDR併用療法の第II相試験が行われ、2年OSで88%と良好な成績であったが50)、その後行われた術後XELOX療法8サイクルとの第III相試験 (NSABP C-09試験) は、集積不良のため途中中止されている。
一方で、肝動注療法にBevacizumab併用の有効性を検討した無作為化比較第II相試験では、Bevacizumabの上乗せ効果は示唆されず、逆にBevacizumab併用群で胆管狭窄の頻度が高かった51)。
以上より、現時点では術後肝動注療法は明確なエビデンスがなく、推奨される治療とは言えない。また、利便性や分子標的治療薬など新規薬剤の開発により、全体の流れは全身化学療法にシフトしている。
切除可能肝転移に対する術前化学療法は、メリットとデメリットが指摘されており、有用性についてのコンセンサスは得られていない。EORTC40983 (EPOC) 試験は、切除可能肝転移1〜4個を有する患者を対象に、術前および術後にFOLFOX4療法をそれぞれ6サイクルずつ施行する群 (化学療法群) と手術単独群とを比較する第III相試験であり、2007年に結果が報告された。
主要評価項目であるintention to treat解析 (n=364) の3年PFSは化学療法群35.4% vs. 手術単独群28.1%であり、化学療法群で良好な傾向であったものの有意差はなかった (HR=0.79, p=0.058)。しかし、化学療法群のうち実際に投与を受けた「適格例」(n=171) および手術単独群のうち登録時に手術適応と判断された「適格例」(n=171) の計342例を対象とした解析では、化学療法群で有意に良好な結果であった (HR=0.77, p=0.041)。また、術後合併症は化学療法群で25%、手術単独群では16%と化学療法群で頻度が高かった (p=0.04) が、手術関連死は両群とも1%未満であった52)。
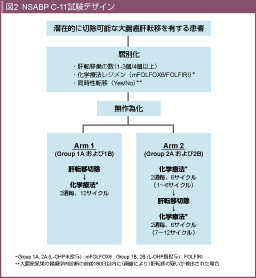
この結果を受け、米国では標準治療である術後補助化学療法に対し、術前+術後補助化学療法の優越性を検証するNSABP C-11試験が行われている (図2)。2011年12月に目標の670例の集積が終了し、現在フォロー中である53)。
一方、欧州ではEORTC40983試験の結果から、切除可能な肝転移症例では術前+術後化学療法を行うことが標準治療の1つと認識され (参照:3.3.2 EU Expert Panel recommendation)、KRAS 野生型切除可能大腸癌を対象に術前+術後FOLFOX/XELOX療法を標準治療として、Cetuximabの上乗せを検証する第III相試験 (New EPOC試験) 54)、BevacizumabおよびPanitumumabの上乗せを探索する無作為化比較第II相試験であるEORTC40091 (BOS2) 試験55)が進行中である。
なお、以前、FOLFOX+Cetuximab群とFOLFOX+Cetuximab+Bevacizumab群の無作為化比較第II相試験 (EORTC40051 BOS試験) が行われていたが、CAIRO2試験56)、PACCE試験57)の結果から抗EGFR抗体薬+Bevacizumab併用の有用性が示されなかったため、41例を登録した時点で試験が中止されている。
・術前に化学療法を行うメリット、デメリット
肝切除前に化学療法を行うメリットは、(1) 肝転移巣が縮小することでR0切除率が上がる、(2) 術前化学療法のほうが術後に比較して忍容性が高い、(3) 薬剤感受性を病理学的に評価できる、ことが考えられる。逆に、デメリットは (1) 正常組織への傷害により術後合併症が増加する、(2) 画像上CRになった病変に対する切除が困難、(3) 効果が得られず増悪した場合にR0切除ができなくなる可能性、などが挙げられる。
多剤併用の薬物療法による肝障害として、脂肪肝、脂肪性肝炎 (yellow liver)、類洞拡張 (blue liver) などが報告されている。特にOxaliplatin (L-OHP) は類洞拡張、CPT-11は脂肪性肝炎のリスクを高めることが知られている。また、FOLFOX療法は6サイクル以上で肝切除後の合併症増加52,58)および類洞拡張のリスク増加59)、12サイクル以上では再手術のリスク増加や術後在院日数の長期化が報告されている60)。一方で、3〜4ヵ月間 (FOLFOXレジメン6サイクル) 以内のL-OHPの使用は類洞拡張や術後合併症のリスクを増加させないと報告されていること、またFOLFOX療法のtime to response中央値が4〜6サイクルと報告されている61)ことから、4〜6サイクル終了時点が肝切除のタイミングの1つと考えられる。
中等度から高度の脂肪肝も術後合併症のリスクを上昇させると考えられている62)。脂肪性肝炎例では、非合併例と比較して術後90日間の死亡率が有意に高い (脂肪性肝炎例14.7%、非合併例1.6%、p<0.001) という報告もある63)。
また、Bevacizumabは血管増生にかかわるVEGFの阻害剤であるため、創傷治癒に関連する術後合併症の増加が当初から懸念されていた。Bevacizumab併用患者の観察研究においては、重篤な術後創傷合併症の頻度は2〜4.4%と報告されているが64,65)、AVF2107g試験を含む2つの無作為化比較試験に登録された患者を対象に、術後合併症の頻度を検討した結果、大手術後のgrade 3以上の創傷合併症は、有意ではないもののBevacizumab併用療法施行中の群で多い傾向にあった (化学療法群3.4% vs. Bevacizumab併用群13%) 66)。現在、Bevacizumab投与例に対しては、予定された大手術の前はBevacizumabの半減期 (20日: 範囲11〜50日) の約2倍である投与後6週間程度67) の休薬期間を設けることが、またBevacizumabの再開時期については術後4週間以降68)が推奨されている。
なお、CetuximabおよびPanitumumabの術前投与期間や周術期合併症に関する報告は少なく、現在のところ、特に合併症発生率を上昇させるという報告はなされていない69)。
今後、術前・術後補助化学療法の最適レジメン、投与期間、手術時期、肝毒性を含めた周術期合併症に関するさらなる研究が望まれる。
GI cancer-net
消化器癌治療の広場