Capecitabine+Cisplatin(CDDP)+Trastuzumab
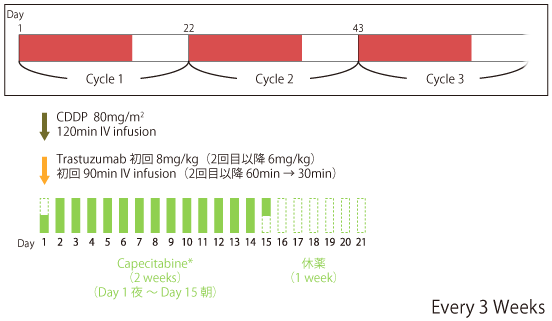 |
| *体表面積 | 1.36m2未満 | 2,400mg/m2/day/分2 |
| 1.36〜1.66m2未満 | 3,000mg/m2/day/分2 | |
| 1.66〜1.96m2未満 | 3,600mg/m2/day/分2 | |
| 1.96m2以上 | 4,200mg/m2/day/分2 |
Bang YJ, et al.: Lancet. 376(9742): 687-697, 2010
Trastuzumabは、ErbBファミリーの受容体であるHER2(human epidermal growth factor receptor type 2)蛋白の細胞外ドメインに結合することでシグナル伝達を阻止し、抗腫瘍効果をもたらすヒト化モノクローナル抗体である。
日本も参加した国際共同第III相試験(ToGA試験1))の結果に基づき、2011年3月に「HER2過剰発現が確認された治癒切除不能な進行・再発の胃癌」の適応で承認を受けている。
◆ToGA試験1)
HER2過剰発現が認められる胃または胃食道接合部の腺癌を対象に、Trastuzumabの有効性と安全性を検証する国際多施設共同無作為化第III相試験が行われた。適応症例594例が「Capecitabineまたは5-FU+CDDP(XP/FP)群」と「Capecitabineまたは5-FU+CDDP+Trastuzumab(XP/FP+Tmab)群」に1:1に無作為化された(解析対象は584例)。
■有効性
主要評価項目である全生存期間(OS)の中央値は、XP/FP群11.1ヵ月、XP/FP+Tmab群13.8ヵ月であり、Trastuzumab併用により有意な延長を認めた(p=0.0046)。
サブグループ解析では、HER2発現度で「IHC 0または1+/FISH陽性(低発現)群」と「IHC 2+/FISH陽性またはIHC 3+(高発現)群」に層別化し、比較検討された。その結果OS中央値は、HER2低発現群ではXP/FP群8.7ヵ月、XP/FP+Tmab群10.0ヵ月、HR=1.07(95% CI: 0.70-1.62)であり、Trastuzumabの有効性は示されなかったが、HER2高発現群ではXP/FP群11.8ヵ月、XP/FP+Tmab群16.0ヵ月、HR=0.65(95% CI: 0.51-0.83)とTrastuzumabによるOS延長効果がより強調された。
| XP/FP群 | XP/FP+Tmab群 | HR(95% CI) | P値 | |
| 奏効割合 | 35% | 47% | - | - |
| PFS中央値(n=584) | 5.5ヵ月 | 6.7ヵ月 | 0.71 (0.59-0.85) |
0.0002 |
| OS中央値(n=584) | 11.1ヵ月 | 13.8ヵ月 | 0.74 (0.60-0.91) |
0.0046 |
| HER2低発現群 OS中央値(n=131) |
8.7ヵ月 | 10.0ヵ月 | 1.07 (0.70-1.62) |
- |
| HER2高発現群 OS中央値(n=446) |
11.8ヵ月 | 16.0ヵ月 | 0.65 (0.51-0.83) |
- |
PFS:無増悪生存期間
■安全性
Grade 3以上の治療関連有害事象は、XP/FP群68%、XP/FP+Tmab群68%であり、減量や中止が必要となったのは82% vs. 84%と、両群に有意な差は認めなかった。
最終投与60日以内死亡はXP/FP群7%(20例)vs. XP/FP+Tmab群5%(15例)であったが、治療関連死亡は1%(3例)vs. 3%(10例)であった。
XP/FP+Tmab群で5%以上に発現したGrade 3以上の治療関連有害事象は、好中球減少(27%)、貧血(12%)、下痢(9%)、嘔気(7%)、嘔吐(6%)、食欲不振(6%)、発熱性好中球減少症(5%)、血小板減少(5%)、無力症(5%)であり、下痢(9% vs. 4%)以外はXP/FP群と頻度は同程度であった。Grade 3以上のinfusion-related reactionはXP/FP+Tmab群において6%(17例)で認めたが死亡例はいなかった。
レジメン解説執筆:国立がん研究センター中央病院 消化管内科 石川 将史 先生
- 副作用対策講座「下痢」
- 副作用対策講座「悪心・嘔吐」
- 副作用対策講座「インフュージョンリアクションとアレルギー反応」
GI cancer-net
消化器癌治療の広場
