IRIS+Bevacizumab
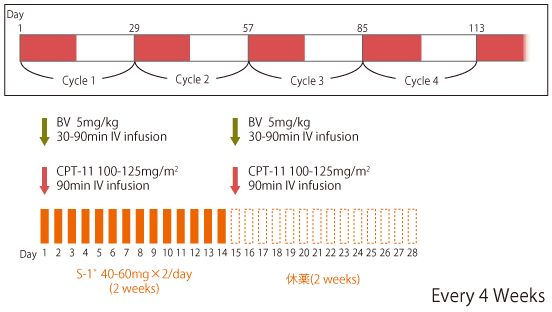 |
|
*S-1の用量は体表面積(m2)により調整 |
Muro K, et al.: Lancet Oncol. 11(9): 853-860, 2010 |
FIRIS試験(第II/III相試験)において、2次治療としてのFOLFIRIに対するIRISの非劣性が検証された1)。IRISの第I相試験に基づき、FIRIS試験のCPT-11は125mg/m2であったが、IRIS+Bevacizumab(BV)の第II相試験は、安全性を考慮して100mg/m2で行われた。その有効性・安全性に基づきmFOLFOX6/CapeOX+BVに対するIRIS/SIR+BVの非劣性を検証する第III相試験(TRICOLORE試験)は、IRISのCPT-11は100mg/m2で行われ、非劣性が検証された。
◆FIRIS試験
CPT-11投与歴のない切除不能進行・再発大腸癌患者における2次治療としてのFOLFIRI(n=213)に対するIRIS(n=213)の非劣性を検証した第II/III相試験である。
■有効性
観察期間中央値は12.9ヵ月であった。主要評価項目であるPFSは、FOLFIRI群の中央値5.1ヵ月、IRIS群の中央値5.8ヵ月であり(HR 1.007, 95% CI: 0.88-1.32, pnon-inferiority=0.039)、FOLFIRIに対するIRISの非劣性が検証された。
副次的評価項目(FOLFIRI群/IRIS群)であるOSは、中央値18.2/19.5ヵ月(HR 0.909, 95% CI: 0.70-1.18)、奏効割合は17/19%であった。
| FOLFIRI (n=213) |
IRIS (n=213) |
HR (95% CI) |
P値 | |
| 奏効割合 | 17% | 19% | − | − |
| PFS | 5.1ヵ月 | 5.8ヵ月 | 1.007 (0.88-1.32) |
0.039 |
| OS | 18.2ヵ月 | 19.5ヵ月 | 0.909 (0.70-1.18) |
− |
■安全性
Grade 3以上の有害事象(FOLFIRI群/IRIS群)は、好中球減少(52/37%)はFOLFIRI群で高頻度であり、下痢(5/21%)、口腔粘膜炎(1/3%)、疲労(3/9%)、食欲不振(5/11%)、発熱性好中球減少症(1/5%)は、IRIS群で高頻度であった。
IRIS(CPT-11 100mg/m2)+BVは、切除不能進行・再発大腸癌の1次治療として第II相試験(n=52)が施行され、安全性(Grade 3以上の有害事象:好中球減少27%、下痢17%、高血圧21%、貧血12%)と有効性(奏効割合64%、PFS中央値17.0ヵ月、OS中央値39.6ヵ月)が確認された2)。
FIRIS試験とIRIS+BVの第II相試験の結果から、切除不能進行・再発大腸癌2次治療においてIRIS+BVが推奨されるレジメンの1つとなっている。
レジメン解説執筆:愛知県がんセンター中央病院 薬物療法部 加藤 恭子 先生/舛石 俊樹 先生
References
GI cancer-net
消化器癌治療の広場
