切除不能肝転移に対する治療は、全身化学療法が主体となる。しかし、全身化学療法開始前には根治切除不能もしくはborderlineであった転移巣が奏効により根治切除術へ移行できることがある。これをconversion therapyという。適切な和訳用語がなく、治療前に切除可能ではない点でneoadjuvant chemotherapyと区別され、食道癌におけるsalvage surgeryと似た意味で使用される。
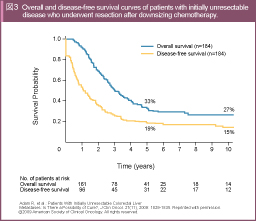
Adamらは切除不能肝転移を有する大腸癌を対象に、L-OHP併用レジメンなどによる化学療法施行後に根治切除ができた群の5年OS、10年OSが33%、27%と良好であり、根治と考えられる5年以上無再発の症例も16%であったと報告した70) (図3)。この成績は初回切除可能肝転移例に対する手術成績と比較しても遜色ないことから、conversion therapyにより一定割合で根治が期待できると考えられる。
腫瘍が著明に縮小し画像検査にて完全奏効 (CR) となった肝転移巣の再発率は低いという報告がある一方、病理組織学的には38〜83%に癌の遺残を認めるという報告もある71,72)。以上より、病変が著明に縮小し術前の画像検査にて病変の同定が困難になった場合でも、術中USを使用し、可能な限り病変を切除するほうがよいと考えられている。このため、化学療法の評価は4〜8週毎に行い、治癒切除が可能となった段階で速やかに切除に移行することが推奨される。
・FOLFOX療法とFOLFIRI療法
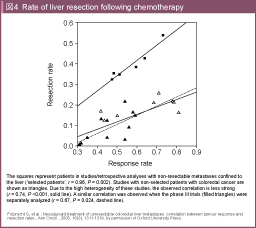
Folprechtらは、切除不能大腸癌に対する化学療法の奏効率と肝転移切除率の間には強い相関関係があると報告した73) (図4)。すなわち、conversion therapyを目指すには奏効率の高い多剤併用レジメンが有望であると考えられる。
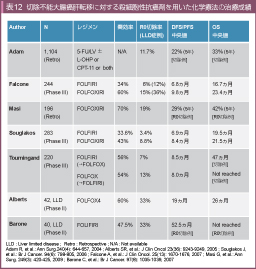
切除不能大腸癌に対する初回化学療法としてFOLFOX療法とFOLFIRI療法を比較したGERCOR V308試験では、両治療の奏効率は同程度であったが (FOLFOX群 vs. FOLFIRI群=56% vs. 54%)、肝切除率 (22% vs. 9%, p=0.02) ならびにR0切除率 (13% vs. 7%, p=0.26) はFOLFOX群で良好な傾向にあった9)。一方で、イタリアで行われたGOIM試験では、FOLFOX群およびFOLFIRI群において、奏効率 (34% vs. 31%)、肝切除率 (4.4% vs. 5.1%) ともに差を認めなかった74)。
肝限局転移 (Liver limited disease:LLD) を有する切除不能大腸癌を対象にした前向き試験としては、BaroneらがFOLFIRI療法 (奏効率47.5%、肝切除率32.5%)75)、AlbertsらがFOLFOX4療法 (奏効率60%、肝切除率 33%) の結果を報告している76)。
以上より、奏効率および肝切除率はFOLFOX療法とFOLFIRI療法では同程度、もしくはFOLFOX療法で良好であるという報告があること、さらに先述したように、化学療法による肝障害 (脂肪性肝炎、類洞拡張) の観点から、L-OHPベースレジメンが好まれる傾向にある (参照: 3.1.2.2 術前+術後補助化学療法)。
・FOLFOXIRI療法
FOLFOXIRI療法 は5-FU/LV、CPT-11とL-OHPを併用する治療法であり、FOLFIRI療法と比較して奏効率、肝転移に対するR0切除率が高いことが報告されている77-79)。また、FOLFOXIRI+Bevacizumab療法の第II相試験では、奏効率77%、R0切除率26%であり、LLD症例30例では奏効率80%、R0切除率40%と良好な成績が報告されている80)。現在、切除不能大腸癌を対象にFOLFOXIRI+Bevacizumab療法とFOLFIRI+Bevacizumab療法を比較する第III相試験 (TRIBE試験) が行われている81)。FOLFOXIRI療法は、海外からの報告でFOLFOX、FOLFIRIを上回る奏効率ならびに肝切除率が報告され、治療選択肢の1つとして認識されているが、本邦での治療成績に関する報告は限られており、臨床試験での実施が必要と考える。
・Bevacizumab
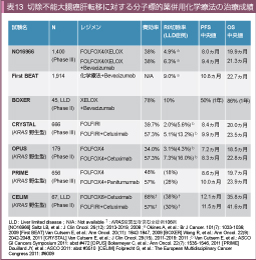
切除不能大腸癌を対象に、一次治療としてのIFL療法に対するBevacizumab併用の有効性を検証したAVF2107g試験では、placebo群と比較してBevacizumab併用群において有意な奏効率の上昇を認めた (34.8% vs. 44.8%, p=0.004) 82)。また、二次治療としてFOLFOX4療法へのBevacizumabの上乗せを検証したE3200試験においても同様に奏効率の上昇が認められた (8.6% vs. 22.7%, p<0.0001) 83)。しかし、一次治療としてFOLFOX4/XELOX療法へのBevacizumabの上乗せを検証したNO16966試験では、placebo群とBevacizumab群で奏効率 (49% vs. 47%, p=0.31) 84)、転移巣のR0切除率 (4.9% vs. 6.3%) に差を認めなかった10)。
一方、LLD症例に対象を限定したXELOX+Bevacizumab療法の第II相試験 (BOXER試験) では、30例中12例 (40%) で切除可能になったと報告され85)、Bevacizumab使用例の観察研究であるFirst BEAT試験では、LLD症例に対するR0切除率はCPT-11ベースの化学療法で11.7%、L-OHPベースの化学療法では15.4%と比較的良好な成績が報告されている10)。また、FOLFOX/XELOX療法にBevacizumabを併用することにより、病理学的奏効割合 (pathological response) が高まるとの報告もある86, 87)。
以上、Bevacizumabの併用による奏効率およびR0切除率の上乗せ効果については相反する報告があり、conversion therapyにおける有用性は明確になっていない。また、安全性に関しては、Bevacizumabの術前投与は創傷治癒遅延などの術後合併症を増加させる懸念がある一方で、FOLFOX療法による類洞拡張を軽減する効果も報告されている87) (参照: 3.1.2.2 術前+術後補助化学療法)。
・抗EGFR抗体薬
切除不能大腸癌を対象にFOLFOX/FOLFIRI療法に対する抗EGFR抗体薬の上乗せ効果を検証した第III相試験では、KRAS 野生型において奏効率を上昇させることが報告されている12-14)。
切除不能大腸癌を対象に一次治療としてFOLFIRI単独療法とFOLFIRI+Cetuximab併用療法を比較した第III相試験であるCRYSTAL試験では、KRAS 野生型においてCetuximab併用群で有意な奏効率の上昇を認め (39.7% vs. 57.3%, p<0.001) 88)、R0切除率もnon-LLD症例 (1.1% vs. 2.8%)、LLD症例 (5.6% vs. 13.2%) ともにCetuximab併用群で良好であった89)。
FOLFOX療法とFOLFOX+Cetuximab療法を比較したOPUS試験 (第II相試験)においても、奏効率 (34% vs. 57%, p=0.0027) 90)、non-LLD症例でのR0切除率 (2.7% vs. 3.5%)、LLD症例でのR0切除率 (4.3% vs. 16.0%) のいずれもCetuximab併用群で良好な傾向であった89)。さらに、FOLFOX/XELOX療法とFOLFOX/XELOX+Cetuximab療法を比較した第III相試験であるCOIN試験でも、奏効率はCetuximab併用群で良好であった (57% vs. 64%, p=0.049) 14)。
また、FOLFOX療法とFOLFOX+Panitumumab併用療法を比較した第III相試験 (PRIME試験) においても奏効率 (48% vs. 57%, p=0.02)、LLD症例における肝転移R0切除率 (18% vs. 28%) はPanitumumab併用群で良好な傾向であった91)。これらの結果は、併用する化学療法レジメンや抗EGFR抗体薬の種類、non-LLD、LLDに限らず共通して認められる12-14,89,91)。
切除不能のLLDを有する大腸癌を対象としたFOLFOX6+Cetuximab療法、FOLFIRI+Cetuximab療法の第II相試験であるCELIM試験では、FOLFOX6+Cetuximab群で奏効率68%、R0切除率38%92)、PFS中央値 12.1ヵ月、OS中央値35.8ヵ月93)、FOLFIRI+Cetuximab群では奏効率57%、R0切除率30%92)、PFS中央値 11.5ヵ月、OS中央値41.6ヵ月93)であり、両群ともに良好な成績が報告されている (※奏効率とR0切除率は全症例、PFSおよびOSはKRAS 野生型症例)。
以上より、KRAS 野生型大腸癌に対する抗EGFR抗体薬の併用は、FOLFOX、FOLFIRI療法への奏効率およびR0切除率の上乗せ効果が複数の試験で示されていること、また安全性についても術前使用による術後合併症増加の報告がないことから、conversion therapyとして推奨されるレジメンの1つであると考える。
Bevacizumabと抗EGFR抗体薬のどちらが併用薬として有用かに関しては、抗EGFR抗体薬併用とBevacizumab併用の無作為化比較試験であるEORTC40091試験 (BOS2試験) 55)、German AIO study KRK-0306 / FIRE-3試験 (FOLFIRI+Bevacizumab vs. FOLFIRI+Cetuximab) 94)、PEAK試験 (mFOLFOX6+Bevacizumab vs. mFOLFOX6+Panitumumab) 95) など、現在進行中のhead-to-headの試験結果が待たれる。
GI cancer-net
消化器癌治療の広場