XELOX (CapOx)±BV
 |
 |
Cassidy J, et al.: J Clin Oncol. 26(12): 2006-2012, 2008 |
 |
 |
Cassidy J, et al.: J Clin Oncol. 26(12): 2006-2012, 2008 |
Capecitabineはフッ化ピリミジン系の経口抗癌剤であり、体内で5-FUに変換され抗腫瘍効果を発揮する。
Capecitabine単独投与の有用性は、切除不能進行・再発大腸癌を対象とした第III相試験によって検証された。試験群はCapecitabine単独投与 (2,500mg/m2/day/分2) 、対照群は5-FU/LV (Mayo regimen) である。その結果、Capecitabine群では奏効率24.8%、TTP 4.3ヵ月、OS 12.5ヵ月の成績が得られた1)。なお、5-FU/LV群との比較では、RRにおいて有意差が示されたものの (5-FU/LV群:15.5%、p=0.005) 、TTPならびにOSについては有意差は認められなかった。
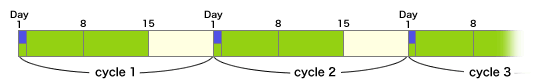
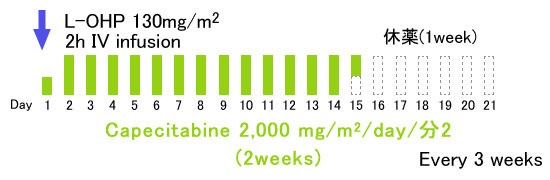
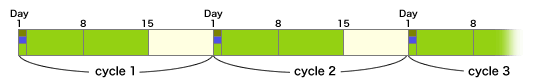
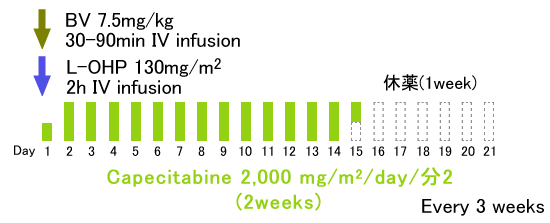
このCapecitabineとL-OHPの併用療法をXELOX、あるいはCapOxと呼んでいる。
XELOX
XELOX + BV
◆XELOX
切除不能進行・再発大腸癌における1st-lineとしてのXELOXとFOLFOX4との同等性を比較・検討した第III相試験がNO16966試験である。同試験は、2003年7月にXELOX vs. FOLFOX4の無作為化オープンラベル比較試験として開始された。その後、Bevacizumab (以下BV) の大腸癌における有効性が明らかになったことから、04年2月にプロトコールが改訂され、XELOXおよびFOLFOX4+BV併用療法の安全性と有効性を評価する2×2デザインの無作為化二重盲検 (BVのみ) 比較試験が追加された。
■有効性
PFSはFOLFOX4±BV群8.5ヵ月、XELOX±BV群8.0ヵ月、OSはそれぞれ19.6ヵ月、19.8ヵ月であり、BV併用を含むXELOX群の同FOLFOX4群に対する非劣性が証明された2) (表1)。
表1
| FOLFOX4±BV | XELOX±BV | |
|---|---|---|
| No.16966 | 1.017 | 1.017 |
| PFS* (月) | 8.5 | 8.0 |
| ハザード比 | 1.04 | |
| 97.5%CI | 0.93-1.16 | |
| OS† (月) | 19.6 | 19.8 |
| ハザード比 | 0.99 | |
| 97.5%CI | 0.88-1.12 | |
Intention-to-treat analysis
* General definition
† cut-off date: January 31, 2007
■安全性
XELOXとFOLFOX4の安全性を解析するために、XELOX/XELOX + placebo (XELOX群) とFOLFOX4/FOLFOX4 + placebo (FOLFOX4群) とが比較された。Grade 3/4の有害事象は両群で同程度であったが、FOLFOX4群ではgrade 3/4の好中球減少 (44% vs. 7%) 、発熱性好中球減少 (4.8% vs. 0.9%) 、静脈血栓塞栓症 (6.3% vs. 3.8%) が多くみられた。一方、XELOX群ではgrade 3の下痢 (19% vs. 11%) 、手足症候群 (6% vs. 1%) が多くみられた (表2)。
◆XELOX+BV
NO16966試験では、FOLFOX4/XELOX群 vs. FOLFOX4/XELOX+BV群の比較において、BV併用群の優越性が検証された。
■有効性
同試験の主要評価項目であるPFSについては、FOLFOX4/XELOX群8.0ヵ月 vs. BV併用群9.4ヵ月 (HR = 0.83, p=0.0023) であり、BV併用群の優越性が有意差をもって示された3) (表3) 。一方、副次評価項目であるOSについては、19.9ヵ月 vs. 21.3ヵ月 (HR=0.89, p=0.0769) であり、有意差は示されなかった。
なお、サブグループ解析では、XELOX±BV群においてBV併用による有意なPFSの延長効果が認められたのに対し(p=0.0026)、FOLFOX4±BV群では有意な上乗せ効果は認められなかった(p=0.1871)。
表3
| FOLFOX4/ XELOX |
FOLFOX4/ XELOX+BV |
FOLFOX4 | XELOX | |||
|---|---|---|---|---|---|---|
| FOLFOX4 | BV併用 | XELOX | BV併用 | |||
| No. | 701 | 699 | 351 | 349 | 350 | 350 |
| PFS* (月) | 8.0 | 9.4 | 8.6 | 9.4 | 7.4 | 9.3 |
| ハザード比 | 0.83 | 0.89 | 0.77 | |||
| 97.5%CI | 0.72-0.95 | 0.73-1.08 | 0.63-0.94 | |||
| p値 | 0.0023 | 0.1871 | 0.0026 | |||
| OS† (月) | 19.9 | 21.3 | 20.3 | 21.2 | 19.2 | 21.4 |
| ハザード比 | 0.89 | 0.94 | 0.84 | |||
| 97.5%CI | 0.76-1.03 | 0.75-1.16 | 0.68-1.04 | |||
| p値 | 0.0769 | − | − | |||
Intention-to-treat analysis
*General definition
†cut-off date: January 31, 2007
■安全性
表4にXELOX/FOLFOX4 + placeboとXELOX/FOLFOX4 + BVの安全性を示す。有害事象による治療中止はそれぞれ21%、30%とBV併用群で多くみられた。BVに関連するgrade 3/4の有害事象はそれぞれ8%、16%とBV併用群で多くみられた。なかでも最も多くみられたのが血栓塞栓症 (8%) であり、高血圧は4%、出血は2%であった。
Reference
- 1) Hoff PM, et al.: J Clin Oncol. 19(8): 2282-2292, 2001
- 2) Cassidy J, et al.: J Clin Oncol. 26(12): 2006-2012, 2008
- 3) Saltz LB, et al.: J Clin Oncol. 26(12): 2013-2019, 2008
GI cancer-net
消化器癌治療の広場
