Cetuximab単剤
 |
 |
Jonker DJ, et al.: N Engl J Med. 357(20): 2040-2048, 2007 |
Cetuximabは、上皮成長因子受容体 (EGFR) を標的とした分子標的薬である。分子量約151,800のIgG1サブクラスのヒト/マウスキメラ型モノクローナル抗体で、米国California大学San Diego校にて開発された。リガンドのEGFRへの結合をブロックすることでEGFRを介したシグナル伝達を阻害し、腫瘍の増殖を抑制すると考えられている。現在、大腸癌、頭頸部癌などに対する有用性が確認されている。
※近年、がん組織のKRAS 遺伝子変異とCetuximabの有効性に密接な相関があることが相次いで報告された。RAS の活性化は、EGFRの活性化から始まる細胞内シグナル伝達の下流に位置する反応である。RAS の恒常的な活性化を伴うKRAS 遺伝子変異例(mutant)では、Cetuximabの有効性が期待できないことが明らかになった。そのため、CetuximabはKRAS 遺伝子に変異がない野生型(wild-type)に対する投与が推奨されている。
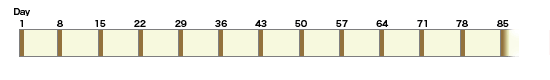
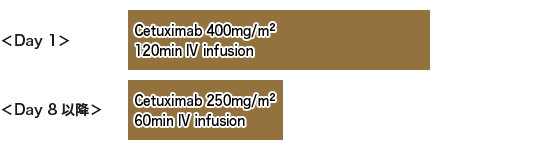
◆NCIC CTG CO. 17試験
切除不能進行再発大腸癌に対する三次治療としてのCetuximabのエビデンスとして挙げられるのが、NCIC CTG CO.17試験である。NCIC CTG CO.17試験は、フッ化ピリミジン系薬剤、CPT-11、およびL-OHPのいずれにも不応性であるか、これらの使用によって容認できない有害事象が出現した、EGFRが陽性である転移を有する大腸癌患者を対象とした第III相試験である。症例は、Cetuximab+best supportive care(BSC)およびBSC単独に無作為に割り付けられた。
■有効性
OSの中央値は各々6.1ヵ月と4.6ヵ月(HR: 0.77, p=0.0046)であり、Cetuximab投与群で有意に良好であった。また、PFSについては、腫瘍の増大もしくは死亡に対するHRがCetuximab投与群で0.68(p<0.001)と、Cetuximab投与群において有意に良好であった。以上より、転移を有する進行大腸癌に対する三次治療としてのCetuximab単剤の有効性が確認された1)。
同試験のレトロスペクティブな追加解析(KRAS status別)は下表の通りである2)。
| KRAS 野生型(n=230) | KRAS 変異型(n=164) | |||||||
|---|---|---|---|---|---|---|---|---|
| Cetuximab 単剤+BSC (n=117) |
BSC (n=113) |
p値 | HR (95% CI) |
Cetuximab 単剤+BSC (n=81) |
BSC (n=83) |
p値 | HR (95% CI) |
|
| 奏効率 | 12.8% | - | 1.2% | - | ||||
| OS中央値 (月) |
9.5 | 4.8 | <0.001 | 0.55 (0.41- 0.74) |
4.5 | 4.6 | 0.89 | 0.98 (0.70- 1.37) |
| PFS中央値 (月) |
3.8 | 1.9 | <0.001 | 0.40 (0.30- 0.54) |
1.8 | 1.8 | 0.96 | 0.99 (0.73- 1.35) |
■安全性
5%以上の患者に認められたGrade 3/4の有害事象の発現頻度を下表に示す(KRAS status問わず)1)。皮疹、好中球数減少によらない感染、錯乱、その他の疼痛は、BSC群に比べCetuximab単剤群で有意に多かった。また、Grade 3/4の低マグネシウム血症とinfusion reactionはCetuximab単剤群でのみ認められた(それぞれ5.2%、4.5%)。
Reference
- 副作用対策講座「皮膚障害-1 分子標的薬の皮膚障害」
- 副作用対策講座「悪心・嘔吐」
GI cancer-net
消化器癌治療の広場
