IRIS
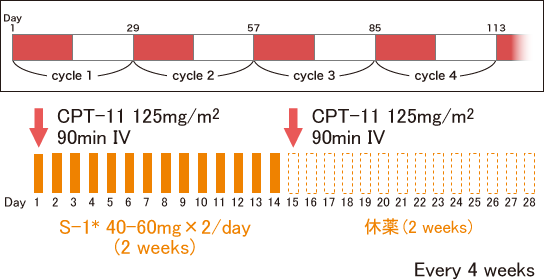 |
*S-1の用量は体表面積(m2)により調整 Muro K, et al.: Lancet Oncol. 11(9): 853-860, 2010 |
S-1は5-FUのプロドラッグであるテガフールに、ギメラシルとオテラシルカリウムを配合した経口抗癌剤である。結腸・直腸癌におけるS-1単剤の有効性については、国内後期第II相A試験で奏効率36.1%、後期第II相B試験では39.5%の奏効率が得られている1)。
IRISはCPT-11 + S-1療法の代表的なレジメンで、CPT-11をday 1と15に、S-1をday 1-14に投与しday 15-28に休薬する4週を1サイクルとする治療法である。
■有効性
2nd-lineにおける有効性:FIRIS試験
2005年、切除不能進行・再発大腸癌の標準的治療のひとつであったFOLFIRI (5-FU/LV + CPT-11) を対象として、IRISの非劣性を検証するために、2nd-lineにおける大規模無作為化比較第II/III相試験 (FIRIS試験)2) が開始された。本試験におけるIRIS群の各薬剤の用量はCPT-11: 125mg/m2、S-1: 40-60mg×2/dayに設定された。
その結果、主要評価項目であるPFS (progression-free survival) の中央値はFOLFIRI群が5.1ヵ月であるのに対し、IRIS群では5.8ヵ月であり (HR=1.077, 95% CI: 0.879-1.319)、FOLFIRIに対するIRISの非劣性が証明された。
1st-lineにおける有効性:HGCSG0302試験
初回治療例に対するIRISの有用性については複数の報告がある。北海道消化器癌化学療法研究会による第II相試験 (HGCSG0302試験)ではCPT-11の用量を100mg/m2とし、奏効率52.5%、PFSの中央値8.6ヵ月、overall survival (OS) の中央値23.4ヵ月という成績が得られた3)。
| 2nd-line (FIRIS, phase II/III) 2) |
1st-line (HGCSG0302, phase II) 3) |
|
| PFS中央値 | 5.8ヵ月 | 8.6ヵ月 [95% CI: 5.3-11.9] |
| OS中央値 | 19.5ヵ月 | 23.4ヵ月 [15.9-30.8] |
| 奏効率 | 18.8% | 52.5% [36.1-68.5] |
■安全性
FIRIS試験
Grade 3/4の有害事象の発現頻度の比較・検討では、好中球減少はFOLFIRI群で有意に高く (FOLFIRI: 52.1% vs. IRIS: 36.2%, p=0.0012)、下痢はIRIS群で有意に高かった (4.7% vs. 20.5%, p<0.0001)。
HGCSG0302試験
最も多くみられたgrade 3/4の有害事象は好中球減少 (45.0%) であり、続いて白血球減少 (27.5%)、貧血 (27.5%) であった。Grade 3/4の非血液毒性としては、下痢 (15.0%)、悪心 (12.5%) がみられた。
| n=40 | ||||
|---|---|---|---|---|
| Grade 1 | Grade 2 | Grade 3 | Grade 4 | |
| 血液毒性 | ||||
| 白血球減少 | 4 | 12 | 9 | 2 |
| 好中球減少 | 8 | 5 | 14 | 4 |
| 貧血 | 7 | 10 | 10 | 1 |
| 血小板減少 | 9 | 2 | 1 | 0 |
| 非血液毒性 | ||||
| 悪心 | 21 | 8 | 5 | 0 |
| 嘔吐 | 12 | 3 | 2 | 0 |
| 下痢 | 12 | 6 | 6 | 0 |
| 口内炎 | 6 | 3 | 1 | 0 |
| 発熱性好中球減少症 | - | - | 2 | 1 |
| 皮疹 | 3 | 3 | 1 | 0 |
| 脱毛 | 20 | 14 | - | - |
| 肝機能不全 | 12 | 3 | 0 | 0 |
| クレアチニン増加 | 5 | 0 | 0 | 0 |
Reference
GI cancer-net
消化器癌治療の広場
