Regorafenib単剤
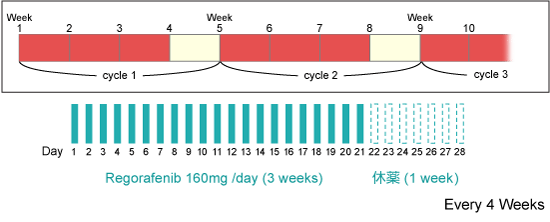 |
Grothey A, et al.: Lancet. 381(9863): 303-312, 2013 |
Regorafenibは腫瘍の血管新生、微小環境および腫瘍形成にかかわる複数のシグナル伝達の阻害作用をもつ経口マルチキナーゼ阻害剤であり、大腸癌で初めて有効性を示した低分子化合物である。
米国では、2012年9月に標準治療の施行後に病勢が進行した切除不能進行・再発大腸癌の治療薬として承認された。本邦では、適応疾患の重篤性と医療上の有用性に基づき、厚生労働省から優先審査の指定を受け、2013年3月に「治癒切除不能な進行・再発の結腸・直腸癌」の適応症で承認された。
◆CORRECT試験
標準治療*抵抗性となった切除不能進行・再発大腸癌におけるRegorafenibの有効性および安全性を検証する国際多施設共同第III相比較試験が行われた。
適格とされた760例が、Regorafenib群 (Regorafenib + BSC) とplacebo群 (placebo + BSC) に2:1の割合で無作為に割り付けられた。
*フッ化ピリミジン系薬剤、L-OHP、CPT-11、Bevacizumab、Cetuximab/Panitumumab (KRAS 野生型患者)
■有効性
主要評価項目であるOS中央値はRegorafenib群6.4ヵ月、placebo群5.0ヵ月であり、Regorafenib群で有意な延長が認められた (HR=0.77, 95% CI: 0.64-0.94, p=0.0052)1)。副次評価項目のPFS中央値はRegorafenib群1.9ヵ月、placebo群1.7ヵ月であり、Regorafenib群で有意に良好であった (HR=0.49, 95% CI: 0.42-0.58, p<0.0001)。
また、KRAS status別のサブグループ解析では、KRAS 野生型、変異型ともにRegorafenib群でOS、PFSが良好な傾向にあった2)。
| Regorafenib (n=505) |
placebo (n=255) |
HR (95% CI) |
||
| OS中央値 (月) |
6.4 | 5.0 | 0.77 (0.64-0.94) | |
| PFS中央値 (月) |
1.9 | 1.7 | 0.49 (0.42-0.58) | |
■安全性
治療に関連した主な有害事象は下表のとおりである。発現頻度の高い有害事象としてRegorafenib群では疲労、手足症候群がそれぞれ47%、placebo群では疲労、食欲不振がそれぞれ28%、15%にみられた。また、多くの有害事象が治療の早い段階 (1〜2サイクル目) で発現した。重篤な有害事象はRegorafenib群の44%、placebo群の40%で報告された。
試験中、Regorafenib群の69例、placebo群の41例が死亡したが、増悪によるものがほとんどであり、有害事象に関連する死亡は110例中11例であった。
Reference
GI cancer-net
消化器癌治療の広場
