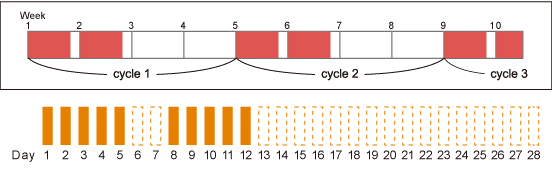
TFTD単剤
 |
 |
|
*TFTDの用量は体表面積(m2)により調整:<1.07=35mg×2; 1.07-<1.23=40mg×2; 1.23-<1.38=45mg×2; 1.38-<1.53=50mg×2; 1.53-<1.69=55mg×2; 1.69-<1.84=60mg×2; 1.84-<1.99=65mg×2; 1.99-<2.15=70mg×2; ≧2.15=75mg×2 |
Mayer RJ, et al.: N Engl J Med. 372(20): 1909-1919, 2015 |
TFTDは、トリフルリジンと、その分解に関与するチミジンホスホリラーゼを阻害するチピラシル塩酸塩を配合した経口ヌクレオシド系抗悪性腫瘍剤である。2014年3月に「治癒切除不能な進行・再発の結腸・直腸癌(標準的な治療が困難な場合に限る)」の適応で世界に先駆けて本邦で承認された。また、2015年3月には「治癒切除不能な進行・再発の結腸・直腸癌」と、適応の一部変更が承認された。
◆RECOURSE試験
標準治療2レジメン以上に抵抗性となった切除不能進行・再発大腸癌患者*におけるTFTDの有効性および安全性を検証する国際多施設共同第III相試験が行われた1)。
適格症例800例が、TFTD群(TFTD+BSC)とプラセボ群(プラセボ+BSC)に2:1の割合で無作為化された。
*フッ化ピリミジン系製剤、Oxaliplatin、Irinotecan、Bevacizumab、CetuximabまたはPanitumumab(KRAS野生型の場合)の各薬剤が投与された患者
■有効性
主要評価項目であるOS中央値は、プラセボ群5.3ヵ月、TFTD群7.1ヵ月であり、TFTD群で有意な延長を認めた(p<0.001)。また、副次評価項目であるPFS中央値は、プラセボ群1.7ヵ月、TFTD群2.0ヵ月であり、TFTD群で有意な延長を認めた(p<0.001)。 サブグループ解析では、KRAS野生型/変異型、日本/欧米および豪州、男性/女性、65歳未満/65歳以上など、ほぼすべてのサブグループにおいて、OS、PFSともにTFTD群で良好であった。
| TFTD群 (n=534) |
プラセボ群 (n=266) |
HR (95% CI) |
P値 | |
| OS中央値 | 7.1ヵ月 | 5.3ヵ月 | 0.68 (0.58-0.81) |
<0.001 |
| PFS中央値 | 2.0ヵ月 | 1.7ヵ月 | 0.48 (0.41-0.57) |
<0.001 |
■安全性
Grade 3以上の有害事象は、プラセボ群52%、TFTD群69%であった。TFTD群においてgrade 3以上の好中球減少は38%、発熱性好中球減少症は4%であり、9%がG-CSF製剤の投与を受け、1例は敗血症性ショックによる治療関連死を認めた。Grade 3以上の貧血はプラセボ群3%、TFTD群18%、血小板減少はそれぞれ1%未満、5%、悪心はそれぞれ1%、2%、嘔吐はそれぞれ1%未満、2%、下痢はそれぞれ1%未満、3%と、TFTD群で多く認められたが、重篤な肝/腎障害、食欲不振、口内炎、手足症候群、心筋虚血では差を認めなかった。
Reference
- 1) Meyer RJ, et al.: N Engl J Med. 372(20): 1909-1919, 2015
- 副作用対策講座「悪心・嘔吐」
- 副作用対策講座「下痢」
- 副作用対策講座「皮膚障害-2 手足症候群」
- 副作用対策講座「口内炎」
GI cancer-net
消化器癌治療の広場
