SIRB
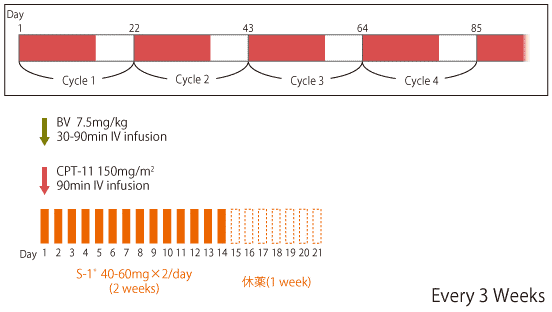 |
|
*S-1の用量は体表面積(m2)により調整 |
Yamada Y, et al.: Invest New Drugs. 30(4): 1690-1696, 2012 |
SIRBは、国立がん研究センター中央病院で開発されたIrinotecan(CPT-11)、Bevacizumab(BV)をday 1に、S-1をday 1-14に投与する3週間1サイクルの治療法であり、第II相試験において有望な有効性と安全性が示された。TRICOLORE試験(第III相試験)において、4週投与法のIRIS+BVとともに、切除不能大腸癌に対する1次治療としてのmFOLFOX6/CapeOX+BV療法に対する非劣性が検証された。
◆SIRB第II相試験
切除不能大腸癌患者に対する1次治療におけるSIRBの第II相試験では、奏効割合67%、PFS中央値12.3ヵ月であり、有望な有効性を示した。また、grade 3以上の有害事象は、好中球減少26%、下痢8%、悪心6%であり、忍容性は良好であった。
◆TRICOLORE試験
切除不能大腸癌患者に対する1次治療として、mFOLFOX6/CapeOX+BV群(n=244)に対するS-1+CPT-11+BV群(SIRB、IRIS+BV)(n=243)の非劣性を検証した第III相試験である。
■有効性
観察期間中央値は32.4ヵ月であった。主要評価項目であるPFSの中央値は、mFOLFOX6/CapeOX+BV群10.8ヵ月、S-1+CPT-11+BV群14.0ヵ月であり(HR 0.84, 95% CI: 0.70-1.02、pnon-inferiority<0.001)、S-1+CPT-11+BV併用療法の非劣性が検証された。非劣性が検証された場合、優越性を検証するデザインとなっていたが、psuperiority=0.082であり、S-1+CPT-11+BV群で良好な傾向であったものの優越性を示すことはできなかった。
なお、レジメンごとのPFS中央値はそれぞれ、mFOLFOX6+BV群11.4ヵ月、CapeOX+BV群10.4ヵ月、SIRB群13.2ヵ月、IRIS+BV群14.3ヵ月であった。
副次的評価項目(mFOLFOX6/CapeOX+BV群/S-1+CPT-11+BV群)は、TTFは中央値7.7/9.6ヵ月(HR 0.71, 95% CI: 0.59-0.85, p=0.0002)であり、S-1+CPT-11+BVで有意に良好であったが、OSは中央値33.6/34.9ヵ月(HR 0.86, 95% CI: 0.66-1.13, p=0.28)、奏効割合は71/66%(p=0.34)であり有意差は認めなかった。
| mFOLFOX6/CapeOX+BV (n=243) |
S-1+CPT-11+BV (n=241) |
HR (95% CI) |
P値 | |
| PFS | 10.8ヵ月 | 14.0ヵ月 | 0.84 (0.70-1.02) |
<0.001 |
| OS | 33.6ヵ月 | 34.9ヵ月 | 0.86 (0.66-1.13) |
0.28 |
| 奏効割合 | 71% | 66% | − | 0.34 |
■安全性
Grade 3以上の有害事象(mFOLFOX6/CapeOX+BV群/S-1+CPT-11+BV群)は、好中球減少(14/24%)、発熱性好中球減少症(0/3%)、下痢(7/13%)、血栓塞栓症(1/4%)が有意にS-1+CPT-11+BV群で高頻度であった。一方、手足皮膚症候群(6/1%)、末梢性感覚ニューロパチー(22/0%)、麻痺性イレウス(3/0%)はmFOLFOX6/CapeOX+BV群で有意に高頻度であった。
神経毒性についてのQOLは、mFOLFOX6/CapeOX+BV群は経時的に低下したが、S-1+CPT-11+BV群はほとんど変化がなく、有意に良好であった(p<0.0001)。
以上の結果から、切除不能大腸癌の1次治療において、S-1+CPT-11+BV併用療法(SIRB、IRIS+BV)は標準治療の1つとして確立された。
レジメン解説執筆:愛知県がんセンター中央病院 薬物療法部 加藤 恭子 先生/舛石 俊樹 先生
References
GI cancer-net
消化器癌治療の広場
