Capecitabine+Oxaliplatin(L-OHP)+Trastuzumab
 |
| *体表面積 | 1.36m2未満 | 2,400mg/m2/day/分2 |
| 1.36〜1.66m2未満 | 3,000mg/m2/day/分2 | |
| 1.66〜1.96m2未満 | 3,600mg/m2/day/分2 | |
| 1.96m2以上 | 4,200mg/m2/day/分2 |
Ryu MH, et al.: Eur J Cancer. 51(4): 482-488, 2015
複数の無作為化第III相試験1-3)により、進行胃癌に対するCapecitabineやOxaliplatin(L-OHP)の5-FUやCisplatinに対するそれぞれの非劣性が証明されている。また、日本も参加した国際共同第III相試験(ToGA試験4))にてHER2陽性の進行胃癌に対するTrastuzumab(Tmab)の有効性が証明されている。
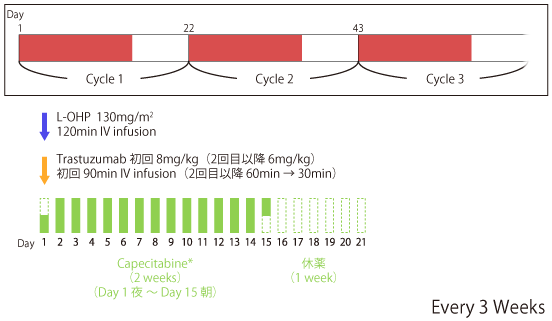
Capecitabine+L-OHP(XELOX)+Tmabについては、第II相試験5)にてHER2陽性進行胃癌での有効性と安全性が確認されている。
◆多施設共同単群第II相試験5)
HER2過剰発現が認められる胃または食道胃接合部の腺癌を対象に、XELOX+Tmabの有効性と安全性を検証する多施設共同単群第II相試験が韓国にて行われた。適応症例55例が対象として臨床試験に参加した。
■有効性
主要評価項目である奏効割合は68%(95% CI: 54-80%)、そのうち、CR:2例(4%)、PR:35例(64%)であった。そのほか、SD:12例(21%)、PD:3例(5%)、評価不能:3例(5%)であった。また副次評価項目である無増悪生存期間(PFS)は9.8ヵ月(95% CI: 7.0-12.6ヵ月)、全生存期間(OS)は21.0ヵ月(95% CI: 6.4-35.7ヵ月)であった。
| 奏効割合(95% CI) | 68%(54-80%) |
| 病勢制御割合(95% CI) | 89%(78-95%) |
| PFS中央値(95% CI) | 9.8ヵ月(7.0-12.6ヵ月) |
| OS中央値(95% CI) | 21.0ヵ月(6.4-35.7ヵ月) |
■安全性
Grade 3以上の治療関連有害事象は、好中球減少(18%)、末梢神経障害(11%)、貧血(11%)、疲労(5%)、食欲不振(4%)、血小板減少(4%)、嘔気(2%)、下痢(2%)、胃炎(2%)、手足症候群(2%)であった。
また、下痢と敗血症に伴う治療関連死亡を1例認めた。
レジメン解説執筆:国立がん研究センター中央病院 消化管内科 石川 将史 先生
References
- 1) Kang YK, et al.: Ann Oncol. 20(4): 666-673, 2009[PubMed]
- 2) Cunningham D, et al.: N Engl J Med. 358(1): 36-46, 2008[PubMed]
- 3) Al-Batran SE, et al.: J Clin Oncol. 26(9):1435-1442, 2008[PubMed]
- 4) Bang YJ, et al.: Lancet. 376(9742): 687-697, 2010[PubMed][論文紹介]
- 5) Ryu MH, et al.: Eur J Cancer. 51(4): 482-488, 2015[PubMed]
GI cancer-net
消化器癌治療の広場
