尿蛋白は血管新生阻害剤で認められる代表的な副作用である。消化器癌領域においては、抗VEGF抗体のBevacizumab、Aflibercept、抗VEGFR抗体のRamucirumabやマルチキナーゼ阻害剤のRegorafenibを投与したときに、1〜3割の患者に尿蛋白の発現が認められる。自覚症状は少なく、患者は尿蛋白の発現に気付くことは困難だが、高度の尿蛋白の異常が認められた場合は、浮腫や倦怠感などを伴うネフローゼ症候群を呈する可能性があり、適切なマネジメントが必要である。
症状
初期には自覚症状は少ないが、浮腫や体重増加、尿の泡立ちを認める。進行すると、ネフローゼ症候群を発症する場合がある。ネフローゼ症候群は、腎不全、血栓症、脂質異常症、感染症の発現リスクを増加させる可能性がある。
発現機序
腎糸球体濾過膜は内皮細胞、基底膜、蛸足細胞で構成されている。蛸足細胞から産生されるVEGFと糸球体内皮細胞上のVEGFR-2との相互作用が糸球体の正常な濾過機能とその修復には不可欠である。
尿蛋白が発現する正確なメカニズムは明らかにされていないが、VEGFの阻害作用により、糸球体構造と濾過機能の破綻が起こり、尿蛋白が生じると考えられている1)。
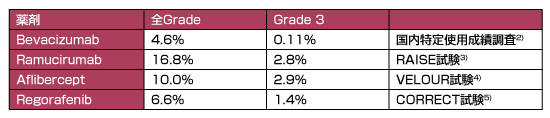
尿蛋白の発現率を表1に示す。全gradeの尿蛋白の発現率は、Bevacizumab:4.6%、Ramucirumab:16.8%、Aflibercept:10.0%、Regorafenib:6.6%である。そのうち、grade 3の尿蛋白の発現率は0.11〜2.9%であり、重篤なものは少ない。
尿蛋白の発現までの日数中央値は、Ramucirumabでは43.5日と報告されている3)が、Bevacizumabの国内特定使用成績調査(対象:結腸・直腸癌)2)では投与期間中いずれの時期においても発現が認められており、一定の傾向はみられていない。
高度の尿蛋白の異常が認められた場合は、ネフローゼ症候群を発症する可能性がある。ネフローゼ症候群の発現率は、Bevacizumab:0.04%、Ramucirumab:0.6%、Aflibercept:0.3%であり2-4)、ネフローゼ症候群を発症することはまれであるが、十分に注意する必要がある。成人ネフローゼ症候群の診断基準を表2に示す。

注:1)上記の尿蛋白量、低アルブミン血症(低蛋白血症)の両所見を認めることが本症候群の診断の
必須条件である。
2)浮腫は本症候群の必須条件ではないが、重要な所見である。
3)脂質異常症は本症候群の必須条件ではない。
4)卵円形脂肪体は本症候群の診断の参考となる。
尿蛋白のCTCAE v4.0の日本語訳JCOG版を表3に示す。
随時尿による尿中蛋白/クレアチニン比(UPC比)と24時間蓄尿による1日尿蛋白量がよく相関するため、24時間蓄尿が困難な場合は、UPC比を測定する。
尿中蛋白/クレアチニン比=尿中蛋白濃度(mg/dL)/尿中クレアチニン濃度(mg/dL)

抗VEGF抗体・抗VEGFR抗体(Bevacizumab、Aflibercept、Ramucirumab)やマルチキナーゼ阻害剤(Regorafenib)投与の際に、尿蛋白の発現が認められる。
Bevacizumabを含むレジメン(Bevacizumab+RPMI、Bevacizumab+Infusional 5-FU/LV、Bevacizumab+S-1、 Bevacizumab+UFT/LV、Bevacizumab+Capecitabine、Bevacizumab+CPT-11、Bevacizumab+FOLFOX、Bevacizumab+CapeOX、Bevacizumab+SOX、Bevacizumab+IFL、Bevacizumab+IRIS、SIRB、Bevacizumab+FOLFIRI、Bevacizumab+FOLFOXIRI)
FOLFIRI+Ramucirumab
FOLFIRI+Aflibercept
Regorafenib単剤
GI cancer-net
消化器癌治療の広場
